
题目列表(包括答案和解析)
6.下列实验室制备有关物质的方法中,合理又实用的是
A.用含少量Cu2+的稀硫酸和锌粒反应制氢气
B.煅烧石灰石制备二氧化碳
C.用NH4Cl溶液和Ca(OH) 2溶液反应制氨气
D.用FeCl3溶液和NaOH溶液反应制Fe(OH) 3胶体
5.用NA表示阿伏加德罗常数,下列说法正确的是
A.78 g Na2O2与足量水反应中电子转移了0.2NA
B.1 mol甲基中含有7 NA 个电子
C.62 g白磷中含P-P键为3 NA
D.1 mol氖气含有的原子数为2 NA
4.希尔实验是将分离出的叶绿素加到草酸铁溶液中,经光照后发生反应:4Fe3++2H2O光照叶绿体4Fe2++4H++O2↑,下列有关该实验的说法错误的是
A.反应后溶液的pH降低
B.每生成1 mol O2转移4 mol电子
C.叶绿体被氧化
D.该实验可说明光合作用产生的氧气来源于水
3.在水中溶入下列物质,可使水的电离平衡向右移动的是
A.H2SO4 B.NaOH C.NH4Cl D.Ba(NO3)2
2.通过化学反应不能实现的是
A.生成一种新离子 B.生成一种新分子
C.生成一种新核素 D.生成一种新单质
1.我国“神舟五号”航天飞船成功发射升空,表明我国的载人航天技术已经有了突破性的进展。在运送飞船的某些火箭推进器中盛有液态肼(N2H4)和液态双氧水,它们充分混合反应后的产物之一是
A.氧气 B.氮气 C.氨气 D.氢气
15.(6分)滴定度是指每毫升标准溶液相当于被测定物质的克数,通常用T表示。例如,T=0.056 g/mL,表示每毫升某标准硫酸溶液恰好与0.056 g氢氧化钾完全反应。
(1)若某标准盐酸溶液对碳酸钙的滴定度为0.05 g/mL,该盐酸溶液的pH为多少?
(2)某不纯的硝酸银样品中Ag+的质量分数为a,取一定质量的该样品溶于水,并用上述盐酸滴定达终点,恰好消耗盐酸a mL,则该盐酸对该硝酸银样品的滴定度T为多少?
(3)某碳酸钠样品中可能混有氢氧化钠和碳酸氢钠,若以酚酞为指示剂(该指示剂变色范围为pH为8-10)。仍用上述标准盐酸溶液滴定,已知盐酸对碳酸钠样品的滴定度为0.073 g/mL,试通过计算确定该样品的成分及碳酸钠的纯度。
13.(10分)有A、B、C三种电解质溶液分别装在三个烧杯中,插有石墨电极,并按下图所示方式在电路中连接。闭合开关K后,测得各支路电流强度IⅠ≈IⅡ(其中IⅡ略小)。
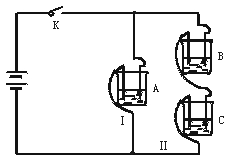
若撤去B,测知电流强度IA《IC;若撤去C,并将A、B两溶液混匀后均分为两等份,再重置于电路Ⅰ、Ⅱ处,测知通过A、B混合溶液的电流强度与先前通过A溶液的电流强度的相对大小关系为:IAB》IA。
已知A、B、C分别选自下列溶液:0.1 mol·L-1盐酸、0.1 mol·L-1醋酸、0.1 mol·
L-1 NaCl溶液、0.1 mol·L-1硫酸、0.1 mol·L-1 NaOH溶液、0.1 mol·L-1氨水,且25℃时A溶液pH<7。
(1)指出A、B、C是(或可能是)什么溶液?
A ;B ;C 。
(2)若向C溶液中滴入酚酞试剂呈红色,则C是 ;将A、B、C分别以等体积进行两两混合,结果是哪种组合的混合液中,水的电离度最大 (填“A”“B”或“C”)。
12.(12分)水的电离平衡曲线如下图所示。
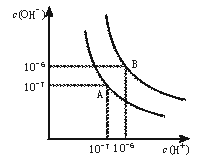
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m?,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g·mL-1,其离子积为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com