
题目列表(包括答案和解析)
1.当前我国环保急待解决的“白色污染”,通常所指的是( )
A.烧制石灰时产生的白色粉尘 B.聚乙烯等塑料垃圾
C.金属冶炼厂排放的白色烟尘 D.白色建筑废料
25.将2 mol A和2 mol B置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:2A (g) 2C+D 2 B+D2
2C+D 2 B+D2 2E
2E
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是______和______,或______和______。
(2)若平衡时D和E的物质的量分别为n(D)平=a mol,n(E)平=b mol。
试求n(A)平=_______(用含a、b的代数式表示)。
24.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应(其中N均为-3价):
KCN+2KOH+Cl2== KOCN+2KCl+H2O
投入过量液氯,可将氰酸盐进一步氧化为氮气:
KOCN+KOH+Cl2 → CO2 + N2 + KCl +H2O
若处理上述废水1000 L,使KCN完全转化为无毒物质,至少需液氯多少克?需1 mol•L-1 KOH 溶液多少升?
23.已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
① c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
② c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
③ c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
④ c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是____________,上述四种离子浓度的大小顺序为_______(填序号)。
(2)若上述关系中①是正确的,则溶液中的溶质为____________;若上述关系中④是正确的,则溶液中的溶质为____________。
(3)若该溶液是由体积相等的稀醋酸和NaOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)______c (NaOH)(填“大于”、“小于”或“等于”,下同),混合前酸溶液中c(H+)和碱溶液中c(OH-)的关系c(H+)______c(OH-)。
22.A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期,C是F不同周期的邻族元素。B原子最外层电子数比其次外层电子数多2;A、B两种元素的核电核数之差等于它们的原子最外层电子数之和;E和F 的原子序数之和为30。现有由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物,这些化合物中的原子个数比如下表:
|
化合物 |
各元素原子个数比 |
|
甲 |
N(A)︰N (C)=2︰1 |
|
乙 |
N(A)︰N (C)=1︰1 |
|
丙 |
N(B)︰N (A)=1︰1 |
|
丁 |
N(D)︰N (C)=1︰1 |
|
戊 |
N(E)︰N (F)=1︰3 |
|
己 |
N(B)︰N (F)=1︰4 |
请回答下列问题:
(1)化合物己的电子式为_________________。
(2)向乙的水溶液中加入MnO2,其氧化产物是________________。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为_________________________________________。
(4)F的单质与甲反应的离子方程式为____________________________。
(5)戊与足量丁投入甲中发生反应的总化学方程式为:
____________________________________________________________。
21.氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上曾普遍采用高纯硅与纯氮在1300℃反应获得。
(1)氮化硅晶体属于__________晶体(填晶体类型)。
(2)已知氮化硅的晶体结构中,原子都以单键相连,且N原子和N原子、Si原子和Si原子不直接相连,同时每个原子都满足8电子稳定结构。请写出氮化硅的化学式___________。
(3)现用四氯化硅和氮气在氢气气氛保护下,加强热反应发生,可得较高纯度的氮化硅。反应的化学方程式为____________________________。
20.现有由某种铁的氧化物与适量铝粉均匀混合而成的混合物,等分成两份后,一份与足量NaOH溶液反应放出H2 m g,一份隔绝空气加热,铝粉与铁的氧化物都恰好完全反应,将反应所得固体与足量盐酸反应,放出氢气n g。
(1)与NaOH溶液反应时,氧化剂是_________,与盐酸反应时还原剂是_________。
(2)若m︰n=1︰1,则铁的氧化物化学式为___________。
(3)若m︰n=4︰3,则该氧化物与铝粉反应的化学方程式为(标出电子转移方向和数目):_____________________________________________。
19.请用图中的装置设计一个实验以测定SO2转化为SO3的转化率:
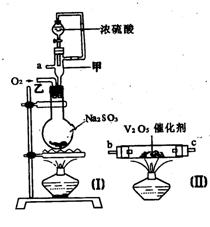
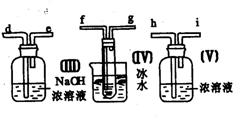
(1)这些装置的连接顺序(按气体从左到右的方向)是____→ ____→
__ →_____→____→____→___→____→(填各接口的编号)。
(2)实验时甲装置的作用是________________________________。
(3)从乙处均匀地通入O2,为使SO2有较高的转化率,实验时(Ⅰ)处滴入浓H2SO4与(Ⅱ)处加热催化剂的先后顺序是__________________。
(4)(Ⅳ)处观察到的现象是______________。
(5)在(Ⅰ)处用大火长时间加热烧瓶,SO2的转化率会_____(填“增大”、“减小”或“不变”),试说明原因_________________________。
(6)用n mol Na2SO3粉末与足量浓H2SO4进行此实验,当反应结束时,继续通入O2一段时间后,称得(Ⅲ)处增重m g(假设m g均为未反应的SO2,且SO2无其他损耗),则本实验中的转化率为__________。
18.下列各组比较项目包含的数据关系中,前者比后者大的是
A.氯水与氨水中的粒子种数
B.同温下100 mL 0.1 mol•L-1 CH3COOH与10 mL 1 mol•L-1 CH3COOH溶液的pH
C.金属镁与金属铝的熔点
D.在物质的量浓度和体积都相等的NaAc和NaCl溶液中总离子数目
17.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1︰16,则x值是
A.2 B.3 C.4 D.5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com