
题目列表(包括答案和解析)
23.(8分)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应”式,另一个是“还原反应”式。如2Fe3++Cu==2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-==Cu2+;还原反应为:2Fe3++2e-==2Fe3+。
⑴请据此将反应3NO2+H2O==2H++2NO3-+NO拆写为两个半反应式。
其中还原反应___________________________________________。
氧化反应___________________________________________。
⑵已知某一反应的半反应式CH4+10OH- -8e-==CO32-+7H2O,O2+2H2O+4e-==4OH-。
则总方程式为____________________________________________________。
(3)熔溶盐燃料电池有很高的发电效率,它可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气和CO2混合气为阴极助燃气,制得在650℃下工作电池。已知阳极电池反应:2CO-4e- + 2CO32-== 4CO2 。
该电池阴极反应__________________________________________________
22.(12分) 右图表示的反应关系中,部分产物被略去,X为l mol固体,A、B、C各为l rnol无色气体,B在常温下为液体,D、E、F为气体,G为液体。则:
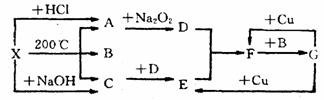
(1)写出化学式 X___________________,C_____________________。
(2) 写出化学方程式:
A→D_________ _______________________________ ____________________;
G→E______ ___________________________________ _______________________;
(3) 工业上合成C, 常用反应物______________________和_________________,合成后采用_____ ____________ __________________________方法分离出C,因为C_________________________________________________________________。
21.(8分)某无色溶液A可能含有Cu2+ NH4+ Al3+ Mg2+ Fe3+ Na+ K+ CO32- SO42- 等离子中的一种或几种。取A加入Na2O2并加热,有无色无臭气体放出,同时生成白色沉淀,加入Na2O2的量X与生成白色沉淀的量W关系如右图。
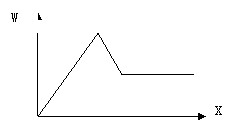 (1)A中一定含有的离子是____________________。
(1)A中一定含有的离子是____________________。
(2)A中一定不含的离子是_______________________。
(3)无法确定是否含有的离子是_______________________,
进一步确定的方法可以用___________________________________________
19.(6分)在体积为250mL的锥形瓶内装有20mL H2O,同时收集满CO2气体,再加入一定量的金属钠后迅速塞紧瓶塞,充分反应后,其气球的变化有三种情况
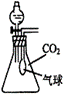 ①当气球无变化时,锥形瓶中反应后溶质为 _____________ ;
①当气球无变化时,锥形瓶中反应后溶质为 _____________ ;
②当气球膨胀时,锥形瓶中反应后溶质为 _____________ ;
③当气球瘪凹时,锥形瓶中反应后溶质为 _____________ 。
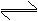 20.(14分)实验室中根据2SO2+O2
2SO3 △H=-196.6kJ,设计如图所示的实验装置来制备SO3固体
20.(14分)实验室中根据2SO2+O2
2SO3 △H=-196.6kJ,设计如图所示的实验装置来制备SO3固体
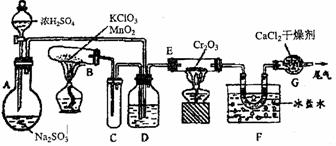
请回答下列问题:
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)_______________(2)小试管C的作用是______________________________________________________
(3)广口瓶D内盛的试剂是_______________装置D的三个作用是:
①______________________________________________________________________;
②______________________________________________________________________;
③______________________________________________________________________.
(4)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防止温度过高,这样做的原因是______________________________________________________________
(5)装置F中U形管内收集到的物质的颜色、状态是___________________________
(6)装置G的作用是________________________________________________________
从G装置导出的尾气的处理方法是用试剂_________________________吸收。
18. 在一定体积的密闭容器中,进行如下可逆反应:CO2(g)+H2(g)=CO(g)+H2O(g),其化学平衡常数K和温度的关系如下表:
|
t/℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
根据以上信息作出的下列判断中正确的是
A.此反应为吸热反应
B.此反应只有在达到平衡时,密闭容器中的压强才不再变化
C.此反应在1000℃达平衡时,c(CO2)·c(H2)/[c(CO)·c(H2O)]约为0.59
D.1100℃时,此反应的K值可能为0.9
第II卷 (非选择题 78分)
17.在调整好的天平左右两盘中间各放一只大小和质量均相等的烧杯,两烧杯中都盛有2mol/L的稀硫酸50mL,然后分别向烧杯中加入下列各组物质,充分反应后天平仍保持平衡的是
A.左10g锌,右10g铁 B.左10g碳酸钠,右10g亚硫酸钠
C.左2g锌,右2g铁 D.左0.5g镁,右0.5g铝
16. A、B为短周期元素,二者能形成化合物AB2。已知A的原子序数为n,B的原子序数为①n+2、②n+5、③n+10、④n+13、⑤n-3、⑥n-6、⑦n-8、⑧n+1,其中
A.①②⑤不可能 B.④⑥不可能
C.⑤⑥不可能 D.①-⑧都可能
15. 对于可逆反应2SO2
+ O2
2SO3,下列判断正确的是:
对于可逆反应2SO2
+ O2
2SO3,下列判断正确的是:
A.2体积SO2和足量O2混和反应,必定生成2体积SO3
B.其它条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速率必定等于O2生成速率的2倍
D.平衡时,SO2浓度必定等于O2浓度的2倍
14. 在一种PH=1的溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种,向该溶液中滴入溴水,单质溴被还原,由此推断该溶液 A.含NO3-、Fe3+,无I-,可能有Cl- B.含I-,不含NO3-、Fe3+,可能有Cl C.含I-、Fe3+、Cl-,肯定不含NO3- D.含I-、NO3-,肯定不含Fe3+
12. 设NA为阿伏加德罗常数,则下列说法正确的是 A.124g白磷中含有P-P键的个数为6NA B.12g石墨中含有C-C键的个数为2NA C.12g金刚石中含有C-C键的个数为2NA D.60gSiO2中含有Si-O键的个数为2NA
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com