
题目列表(包括答案和解析)
|
物 质 |
试剂及主要现象 |
反应原理 |
|||||||
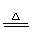   NH3 |
湿红石蕊 试 纸 |
变 蓝 |
NH3+H2O NH3·H2O NH4++OH- |
||||||
|
浓盐酸 |
白 烟 |
NH3+HCl=NH4Cl |
|||||||
NH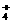 |
NaOH(△) |
有气体放出 |
NH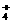 +OH- NH3↑+H2O +OH- NH3↑+H2O |
||||||
|
|
无色变 红棕色 |
|
||||||
 NO2 NO2 |
AgNO3溶液 |
无 沉 淀 |
3NO2+H2O=2HNO3+NO |
||||||
NO |
铜片、 浓H2SO4 (共热) |
|
2NO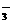 +2H2SO4(浓)+Cu Cu2++2NO2↑+2SO +2H2SO4(浓)+Cu Cu2++2NO2↑+2SO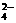 +2H2O +2H2O |
2.氨催化氧化法制HNO3有关事项
(1)为提高原料转化率,应补充空气,多次氧化和吸收
(2)尾气吸收--用碱液
NO+NO2+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO3+NaNO2+H2O
当n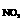 :n
:n ≥1.均可被吸收完全
≥1.均可被吸收完全
(3)硝酸浓度的提高
|
|

 稀硝酸
浓缩
稀硝酸
浓缩
 物 质 物 质
|
实 验 室 制 法 |
工 业 制 法 |
||||||
|
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
|
N2+3H2
2NH3 |
||||||
|
NO |
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
4NH3+5O2 4NO+6H2O |
||||||
|
NO2 |
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O |
2NO+O2=2NO2 |
||||||

|
|
NH3→NO→NO2 3NO2+H2O=2HNO3+NO |
||||||

|
|
Ca3(PO4)2+3H2SO4 2H3PO4+3CaSO4 |
||||||
|
普 钙 (过磷酸钙) |
|
Ca3(PO4)2+2H2SO4=Ca(H2PO4)2+2CaSO4 |
||||||
|
重 钙 |
|
Ca3(PO4)2+4H3PO4=3Ca(H2PO4)2 |
注意
1.NH3的干燥剂选用
① 氨是碱性气体(有水),故不能用酸性干燥剂.如浓H2SO4、P2O5等
② 氨与CaCl2反应生成CaCl2·8NH3.故也不能用无水CaCl2
③ 氨只能用碱性干燥剂如碱石灰
2.氨的结构和性质
|
分子式 |
电子式 |
结构式 |
||
  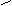 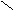 表示式 表示式 |
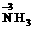 |
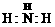 |
H H H |
||
|
特点 |
-3价为N最低价 |
有孤对电子 |
极性分子(三角锥形) |
||
 
|
有还原性 |
与H+等形成配位键 |
极易溶于水(1:700) |
||

  反应: 反应:
|
4NH3+5O2 4NO+6H2O 4NH3+3O2 2N2+6H2O 2NH3+3Cl2 = N2+6HCl |
NH3+H+=NH4+ NH3+HCl=NH4Cl |
NH3+H2O NH3·H2O NH 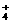 +OH- +OH- |
|
|
|
|
|
|
|
|
|
|
|


|

|

|
|
|



|
|
|
|
|
|








|
|

|
|
|




|
|
|
|
|
易挥发
|
|
|
|
1.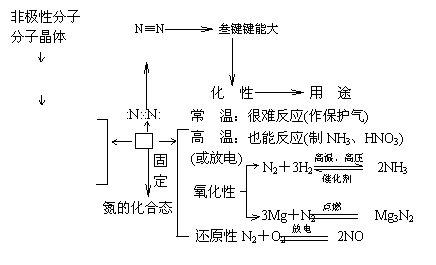 氮气
氮气
物 性
 难溶于水
难溶于水
熔沸点很低 N2
无色无气味
气体
2.NO、NO2、N2O4的性质及转化
|
|
NO |
NO2 |
N2O4 |
||||||
|
颜色 |
无色 |
红棕色 |
无色 |
||||||
|
毒性 |
有 |
有 |
有 |
||||||
|
水溶性 |
难 |
易且反应 |
随NO2与H2O反应,平衡不断移动 |
||||||
|
与O2是否共存 |
否 |
能 |
能 |
||||||
 
相互转化 |
|
1.比较白磷和红磷
|
|
白(黄)磷 |
红(赤)磷 |
|
|
组 成 |
P4 |
Px(x>4) |
|
 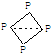 结 构 |
|
结构更复杂 |
|
|
颜 色 |
淡黄 |
暗红 |
|
|
状 态 |
蜡状、质脆、固体 |
粉末状固体 |
|
|
气 味 |
大蒜般的臭味 |
无臭 |
|
|
水溶性 |
不溶 |
不溶 |
|
|
CS2中溶解性 |
易溶 |
不溶 |
|
|
着火点 |
40℃(易自燃) |
240℃ |
|
|
毒 性 |
剧毒 |
无毒 |
|
 用 途 用 途 |
用于制高纯度H3PO4、 制烟幕弹和燃烧弹 |
用于制农药及 安全火柴 |
|
|
相互转变 |
|
||
|
保 存 |
水封密闭 |
密 封 |
|
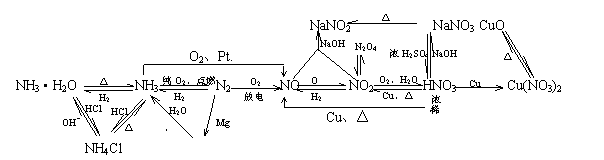
1.氮元素及其化合物间的转化
25.(6分)某CuO粉末与适量的硫酸(ρ=1.7g·cm-3)在微热下充分反应,冷却后恰好全部形成CuSO4·5H2O(设反应过程中无水份损失)。求此硫酸溶液的物质的量浓度。
高考科目教学质量第一次检测
24.(8分)下表是某温度下测得某酸溶液的一些数据,由表中的数据填空
|
溶液的物质的量浓度/mol·L-1 |
电离度/% |
H+的物质的量浓度/mol·L-1 |
pH |
|
0.1 |
2α |
c1 |
x |
|
c |
α |
2c1 |
3 |
则c == ; α== ; c1 == ; x ==
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com