
题目列表(包括答案和解析)
9.由于催化作用使反应速率加快的是······························································· ( )
A、乙酸乙酯水解时加入少量稀硫酸
B、 实验室制取甲烷时,要加入生石灰
C、 苯和液溴反应时,加入少量铁粉
D、锌与盐酸反应,加入少量浓硫酸
8.1体积SO2和3体积O2混合后,在450℃左右通过五氧化二钒催化剂发生如下可逆反应:2SO2(g)+O2(g)==2SO3(g),若在同温同压下测得反应前后混合气体的密度之比为9:10,则二氧化硫的转化率为............ ( )C
A.20% B.62% C.80% D.95%
7.下列事实不能用勒沙持列原理解释的是............................................................ ( )B
A.往氢硫酸溶液中加入碱,有利于S2-增多
B.500℃左右比室温更有利于合成氨
C.配制三氯化铁溶液时,向溶液中加入少量盐酸
D.加入催化剂五氧化二钒,能加快二氧化硫转化为三氧化硫的速度
6.某温度下,可逆反应H2(g)+I2(g)==2HI(g)+Q,在一有活塞的密闭容器中达到化学平衡;下列说法不正确的是 ( )C
A.恒温,压缩体积,化学平衡不移动,颜色加深
B.恒压充入HI(g),开始时正反应速度减小
C.恒容,升高温度正反应速度减小
D.恒容充入氮气,化学平衡不发生移动.
5.某湿度下可逆反应N2O4(g)==2NO2-Q,在密闭容器中达到化学平衡,下列说法正确的是 ( )C.
①加压时(体积变小),将使正反应速度增大;②保持体积不变,加入少量的NO2将使正反应速度减小;③保持体积不变,加入少量N2O4,再次达到化学平衡时,体系颜色变深;④保持体积不变,升高温度,再次达到化学平衡时体系颜色变深.
A. ①④ B. ②③④ C. ①③④ D. ①②③④
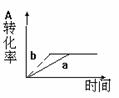
4.对于有气体参加的反应,在右图坐标中纵坐标表示的是( )B
A.温度 B.反应时间
C.反应物浓度 D.压强
3.在一定温度下,可逆反应A2(g)+B2(g)===2AB(g)达到化学平衡的标志是............. ( )C
A.容器内的总压强不随时间而变化
B.单位时间内有nmolA2生成的同时就有nmolB2生成
C.单位时间内有nmolA2生成的同时就有2nmolAB生成
D.单位时间内有nmolB2生成的同时就有nmolAB生成
2. 对于的反应M+N→P,如果温度每升高10℃,化学反应速度增加了2倍;在10℃时完成某反应的10%需要81min,若将温度升高到30℃,完成该反应的10%需要时间为............................................................ ( )A
A.9min B.27min C.13.5min D.3min
1.可逆反应4NH3+5O2==4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速度Vx(表示反应物的消耗速度或生成物的生成速度)( )
A.V(O2)=0.001mol·L-1·S-1 B、V(NO)==0.008 mol·L-1·S-1
C.V(H2O)==0.003 mol·L-1·S-1 D、 V(NH3)==0.002 mol·L-1·S-1CD
27.在Fe与Fe203组成的混合物15g中,加入稀H2S04150mL,放出H2 1.68L(标准状况)。当反应停止时Fe与Fe203均无剩。且溶液中无Fe3+存在。为了中和溶液中过量的H2S04,并使Fe2+完全成Fe(OH)2沉淀,共用去了物质的量浓度为3mol/L的NaOH溶液200ml 。试计算所用H2S04溶液的物质的量浓度。
28(10分)某化工厂每小时生产98%(质量分数)硫酸at,为使硫燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%。若空气中氧化的体积分数为21%,且不考虑各生产阶段的物料损失,则:
①该厂每小时消耗标准状况下空气的体积为___________m3
②满足题设要求,b%的下限等于___________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com