
题目列表(包括答案和解析)
20].(12分)硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2-3遍;
②向洗涤过的废铁屑加入过量的稀硫酸,控制温度50-80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水2-3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是______________,加热的作用是____________________。
(2)实验步骤②明显不合理,理由是_______________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是_____________;_______________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
||
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
|||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
 ⑤若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制的结晶温度(t)的范围为__________。
⑤若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制的结晶温度(t)的范围为__________。
19].(10分)请按要求填空:
(1)下列实验操作或对实验事实的叙述正确的是__________________(填序号)
①用稀硝酸清洗做过银镜反应实验的试管;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加到浓硝酸中,并不断搅拌;
③用碱式滴定管量取20.00mL 0.1000mol/L KMnO4溶液;
 ④用托盘天平称取10.50g干燥的NaCl固体;
④用托盘天平称取10.50g干燥的NaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
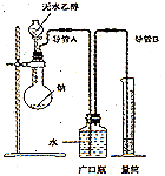
(2)为了确定乙醇分子的结构简式是CH3―O―CH3还是CH3CH2OH,实验室利用右图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目。试回答下列问题:
①指出实验装置的错误_______________。
②若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得氢气的体积将______(填“偏大”、“偏小”或“不变”)。
③请指出能使实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)________________。
18].一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A 2mol C B 2mol A 1mol B和1mol He(不参加反应)
C 1mol B和1mol C D 2mol A 3mol B和3mol C
第二卷(非选择题 共76分)
17].Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A 1∶7 B 1∶9 C 1∶5 D 2∶9
16].某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的是离子组是
A K+、Na+、HCO3-、NO3- B Na+、SO42-、Cl-、ClO-
C H+、Mg2+、SO42-、NO3- D Ag+、K+、NO3-、Na+
15].下列实验方案合理的是
A 配制50g质量分数为5%NaCl溶液:将45mL水加入到盛有5g NaCl的烧杯中,搅拌溶解
B 制备乙酸乙酯:用右图所示的实验装置
C 鉴定SO42-:向溶液中加入盐酸酸化的氯化钡溶液
D 鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中
14].高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C 放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D 放电时正极附近溶液的碱性增强
13].A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3∶4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
A X、Y、Z的稳定性逐渐减弱
B A、B、C、D只能形成5种单质
C X、Y、Z三种化合物的熔、沸点逐渐升高
D 自然界中存在多种由A、B、C、D四种元素组成的化合物
12].常温下将稀NaOH学溶液和稀CH3COOH溶液混合,不可能出现的结果是
A pH>7,且c(OH-)>c(Na+)> c(H+)>c(CH3COO-)
B pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C Ph<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
11].2002年瑞典科学家发现,某些高温油炸食品中含有一定量的CH2=CH-CO-NH2(丙烯酰胺)。食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:①能使酸性KMnO4溶液褪色 ②能发生加聚反应生成高分子化合物 ③只有4种同分异构体 ④能与氢气发生加成反应。其中正确的是
A ①②③ B ②③④ C ①③④ D ①②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com