
题目列表(包括答案和解析)
26.(9分)已知卤代烃R-Cl在一定的条件下可以发生如下反应:
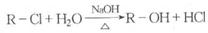
以乙烯为原料进行下图所示的转化关系,可得到主要有机物C和G(下列各步反应条件没有全部注明)。
(1)若乙为氯化氢,则G的结构简式为_________;
若乙为氯气,则G的结构简式可能为__________________。
(2)请填写①②③的反应类型(填序号)
①______ ②______ ③________;
(A)取代反应 (B)加成反应 (C)氧化反应 (D)还原反应 (E)加聚反应 (F)缩聚反应 (G)消去反应
(3)请写出有关反应的化学方程式
D→E:_____________________;
 ;
;
乙为HCl时,E+F→G:___________________。
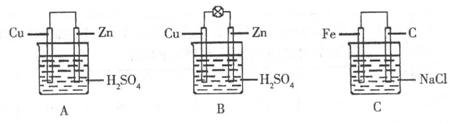
25.(8分)(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片______(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见下图A),组成一个原电池,负极为______,正极的电极反应式为_________。
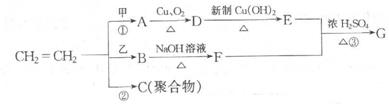
(2)如果烧杯中最初装入的是 500mL的稀硫酸溶液,构成铜锌原电池(见下图B,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)___________。
500mL的稀硫酸溶液,构成铜锌原电池(见下图B,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)___________。
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见下图C),放置数天后,主要发生________电化学腐蚀,写出正极的电极反应式___________。
(4)生活中利用原电池原理生产了各种各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其最主要原因是______。
A.回收利用电池外壳的金属
B.防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
C.防止电池中渗泄的电解液腐蚀其他物品
D.回收其中的石墨电极
24.(7分)在80℃时,将0.20mol的四氧化二氧气体充入1L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
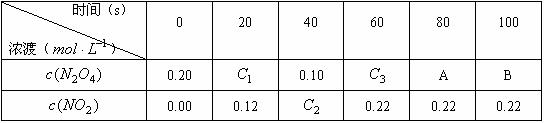
根据本题内容和表格中提供的数据填空(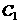 、
、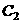 、
、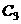 、A、B表示相应的浓度)请回答下列各小题:
、A、B表示相应的浓度)请回答下列各小题:
(1)该反应的化学方程式为__________;达到平衡时四氧化二氮的转化率为_____%,表中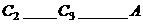 (填“<”、“=”、“>”)。
(填“<”、“=”、“>”)。
(2)20s时,四氧化二氮的浓度 ,在0s~20s内四氧化二氮的平均反应速率为_________________。
,在0s~20s内四氧化二氮的平均反应速率为_________________。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是 。
。
23.(5分)(1)在25℃条件下将pH=3的醋酸溶液稀释100倍,稀释后溶液的pH为(填序号)__________。
A.3 B.5 C.2~3之间 D.3~5之间
(2)25℃时,向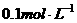 的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH增大,主要原因是(填序号)_______。
的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH增大,主要原因是(填序号)_______。
A.醋酸与醋酸钠发生化学反应
B.醋酸钠溶液水解显碱性,增加了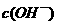
C.醋酸钠溶于水,电离出大量醋酸根离子,抑制了醋酸的电离,使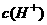 减小
减小
(3)室温下,如果将0.1mol 和0.05molHCl全部溶于水,形成1L混合溶液(假设无损失),请写出溶液中存在平衡的电离方程式和离子主程式_____________。
和0.05molHCl全部溶于水,形成1L混合溶液(假设无损失),请写出溶液中存在平衡的电离方程式和离子主程式_____________。
22.(7分)拟用下图装置和表中所列试剂进行实验并得出实验结论(图中铁架台、铁夹、加热装置等已略去;必要时可以加热;A、B、C表示相应仪器中加入的试剂):
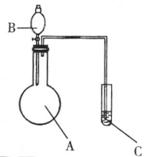
|
序号 |
A |
B |
C |
C中现象 |
实验结论 |
|
① |
碳酸钠 |
醋酸溶液 |
苯酚钠溶液 |
溶液变浑浊 |
酸性:醋酸>碳酸>苯酚 |
|
② |
无水乙醇 |
浓硫酸 |
溴水 |
溴水褪色 |
证明乙烯有碳碳不饱和键可与溴发生加成反应 |
请回答下列问题:
(1)上述实验和结论一定正确的是(填序号)________。
(2)如果你认为上述实验和结论有不合理的,请写出序号并说明理由:
_____________________________________________________________________
(3)请你用上述装置设计一个实验,选择试剂、简述C中的现象并根据实验现象得出实验结论:
所选试剂:A:_____________ B:______________ C:______________;
C中的现象:________________________;
实验结论:________________________。
21.(7分)某同学设计如右图装置制取少量溴苯,请回答下列问题:
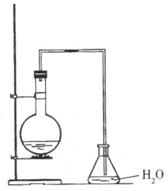
(1)写出实验室制取溴苯的化学方程式:______________________。
(2)上述反应发生后,在锥形瓶中加入硝酸银溶液观察到的现象是_______,这一现象能否说明溴和苯发生了取代反应(填“能”或“不能”)_______,理由是______。
(3)反应后得到的溴苯中溶有少量苯、溴、三溴苯、溴化铁和溴化氢等杂质,欲除去上述杂质,得到无水溴苯的合理实验操作步骤可设计为(分液操作已略去):①水洗②碱洗③水洗④_____⑤______。
(4)上述操作②碱洗的主要目的是(填序号)______。
A.除三溴苯和溴化氢 B.除溴化铁和三溴苯
C.除溴和溴化氢 D.除苯和溴
20.一定条件下,AL密闭容器中放入1mol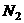 和
和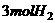 发生
发生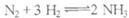 的反应,下列选项中能说明反应已达到平衡状态的是( )
的反应,下列选项中能说明反应已达到平衡状态的是( )
A.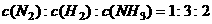
B.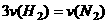
C.单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
D.单位时间消耗0.1mol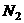 的同时,生成
的同时,生成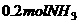
第Ⅱ卷(非选择题 共60分)
19.若常温下某溶液由水电离产生 ,满足此条件的溶液中一定可以大量共存的离子组是( )
,满足此条件的溶液中一定可以大量共存的离子组是( )
A.

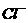
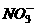 B.
B.
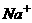
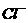
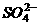
C.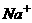
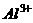
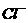
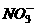 D.
D.
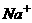
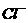
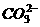
18.以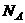 表示阿伏加德罗常数,下列说法中正确的是( )
表示阿伏加德罗常数,下列说法中正确的是( )
A.1.8g 离子中含有的电子数为
离子中含有的电子数为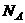
B.常温常压下,1mol甲基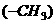 所含电子数为
所含电子数为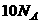
C.28g乙烯含 对共用电子对
对共用电子对
D.1mol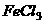 跟沸水反应转化成氢氧化铁胶体后,生成胶体微粒的数目为
跟沸水反应转化成氢氧化铁胶体后,生成胶体微粒的数目为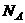
17.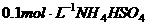 溶液与
溶液与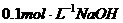 溶液等体积混合,混合后溶液中离子浓度关系表述正确的是( )
溶液等体积混合,混合后溶液中离子浓度关系表述正确的是( )
A.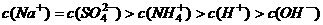
B.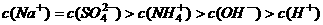
C.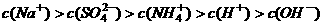
D.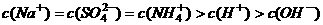
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com