
题目列表(包括答案和解析)
6.航天器的燃料之一是铝粉与高氯酸铵(NH4ClO4)的固体混合物,点燃时,铝粉氧化放热引发高氯酸铵反应,其反应式可表示为:2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑(反应热ΔH<0);下列对该反应的叙述中错误的是
A.NH4ClO4既是氧化剂又是还原剂
B.1molNH4ClO4完全反应时,转移电子14mol
C.反应中只有氯元素被还原
D.从能量角度看,化学能主要转变为热能和动能
5.下列物质间发生化学反应:①H2S+O2 ②Na+O2 ③C2H5OH+O2 ④AlCl3+NaOH ⑤Zn+HNO3 ⑥P2O5+H2O ⑦NH3+O2 ⑧Fe+Cl2 在不同条件下能得到不同产物的是
A.除⑧外 B.除⑤和⑧外 C.除③⑦⑧外 D.全部
4.在实验室中不宜长期保存的是①氯水 ②银氨溶液 ③食盐水 ④FeSO4溶液⑤Na2SO4溶液
A.①②④ B.②④ C.①②③ D.①②④⑤
3.在NH3、HNO3、H2SO4的工业生产中,具有的共同点是
A.使用吸收塔设备 B.使用尾气吸收装置
C.使用H2作原料 D.使用催化剂
2.白云母是重要的无机硅酸盐材料,它的主要成分为K2Al6Si6(OH)nO18,则n为
A.4 B.6 C.8 D.10
1.下列材料的特性及用途的说法中不正确的是
A.光导纤维传导光的能力很强,是非常好的通讯材料
B.氮化铝陶瓷具有两性,不可以用于制造耐高温设备
C.氮化硅陶瓷耐高温且不易传热,可用来制造轴承
D.人造刚玉硬度高,可用来制造刚玉球磨机
(二)若a、b、c三种元素形成的单质(仍用a、b、c表示)和组成的化合物间反应关系式如下(未配平):
①b+c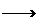 Y
②a+c
Y
②a+c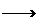 Z
Z
③X+Y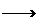 m ④X+Z
m ④X+Z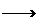 c+n
c+n
⑤Y+Z c+n
c+n
回答下列各题:
(1)最有充分理由说明上述反应中一定属于氧化还原反应的是 (填序号),其充分理由是 。
(2)如果m是一种无色、粘稠的油状液体化合物,则Y、Z分别是 ;写出下列反应方程式③ 。
27、(1)某温度下,向某容积固定的密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若保持温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,令X、Y、Z分别代表初始加入的N2、H2、NH3的物质的量。请填写下列空白:
①若X=0,Y=0,则Z= 。
②若X=0.75,Y= ,Z=- 。
③X、Y、Z应满足的一般条件是 。(请用两个方程式表示,其中一个只含X和Z,另一个只含Y和Z)
(2)若维持温度和压强不变,在一个可变容积的容器中发生上述反应。请填写下列空白:
①若X=0、Y=0,则Z= 。
②若X=0.75,则Y= ,Z= 。
③X、Y、Z应满足的一般条件是
28、已知连接羟基的碳原子上没有氢原子的醇不能发生催化氧化反应。A是一种重要的化工原料,其分子组成为C4H9Cl,A有如下转化关系:
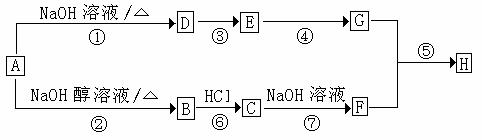
其中F不能发生催化氧化反应,E和G都能和新制Cu(OH)2反应,但反应条件、实验现象不同,H是一种果香味的液体。回答下列问题;
(1)A的同分异构体共有 种,符合条件的A的结构简式为
(2)与①、⑦反应类型相同的反应是 (填序号),若A中混有C,对生成B的纯度是否有影响 (填“是”或“否”),理由是
(3)写出下列反应的化学方程式:
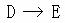
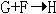
29、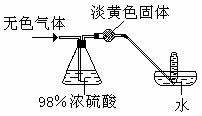 有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),如图示通过洗气瓶,发现气体体积减小一部分;通过干燥管后气体呈红棕色,再将该气体适量地通入盛满水倒立于水槽中的试管内,发现试管内水位下降后又缓慢上升,最后试管内全部充满液体。由此判断:
有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),如图示通过洗气瓶,发现气体体积减小一部分;通过干燥管后气体呈红棕色,再将该气体适量地通入盛满水倒立于水槽中的试管内,发现试管内水位下降后又缓慢上升,最后试管内全部充满液体。由此判断:
原气体中一定有 、一定没有 。
30、 右图所示的A、B两支大试管中各盛有等质量的同一种液体,试管口各系有一个小气球,气球内分别装有等质量的不同固体(纯净物),实验时将两气球抬起,将其中固体同时倾入试管内,固体全部溶解,同时看到两气球都鼓气胀大,但A试管气球胀大的速度及最终胀大的体积都明显大于B。若两试管产生同一种气体,试推测A、B中盛放的液体和固体的可能组合,将各组合填入下表,要求各组分产生的气体不能相同。(可以不填满)
右图所示的A、B两支大试管中各盛有等质量的同一种液体,试管口各系有一个小气球,气球内分别装有等质量的不同固体(纯净物),实验时将两气球抬起,将其中固体同时倾入试管内,固体全部溶解,同时看到两气球都鼓气胀大,但A试管气球胀大的速度及最终胀大的体积都明显大于B。若两试管产生同一种气体,试推测A、B中盛放的液体和固体的可能组合,将各组合填入下表,要求各组分产生的气体不能相同。(可以不填满)
|
组合编号 |
A、B中的液体 |
A中的固体 |
B中的固体 |
产生的气体 |
|
① |
|
|
|
|
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
|
|
⑤ |
|
|
|
|
|
⑥ |
|
|
|
|
31、50ml 0.5mol·L-1的盐酸与50ml0.55mol·L-1的NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
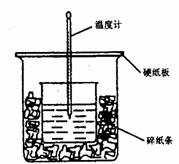
(l)从实验装置上看,图中尚缺少的一种玻璃用品是 。由图可知该装置有不妥之处,应如何改正? 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。简述理由 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会 ;用50mL 0.50 mol·L-1的 NaOH溶液进行上述实验,测得的中和热的数值会_(均填“偏大”“偏小”“无影响”)。
32、在下图中,当容器A中的反应开始后,再进行下列操作:
(1)若弹簧止水夹c打开, B容器中有什么现象发生
.
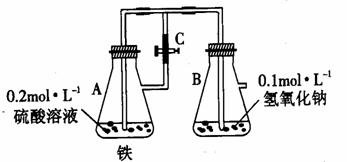 (2)若止水夹C关闭一段时间后,而容器A中的反应仍在进行时,B中有什么现象发生
(2)若止水夹C关闭一段时间后,而容器A中的反应仍在进行时,B中有什么现象发生
,写出B中有关反应的化学方程式 .
(3)若先打开止水夹 C一段时间,让 A中的反应进行,然后再关闭止水夹 C一会儿,B 中所发生的现象是 。其原因是 .
(一)若Y是由c和b元素按原子个数比为1:1组成的化合物。,又知X分子含18个电子,化合物Y含38个电子,请填空:
①元素b在第 周期。
②化合物X的分子式是 。
③化合物Y的电子式是
24、250C时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va <Vb和a=0.5b.请填写下列空白:
1)a值可否等于3(填“可”或“否”) ,其理由是--。
2 )a值可否等于5(填“可”或“否”) ,其理由是一一一。
3 )a 的取值范围是
25、用废铁屑与稀硫酸反应,可制得硫酸亚铁。在100C和500C时,FeSO4在 100 g水中的溶解度分别为20.5 g和 48.6g.常温下,从溶液中析出的晶体是FeSO4·7H2O。现取 200 ml 0.500 mol/L H2SO4溶液,将 8.00 g废铁屑加入到上述稀H2SO4中,并不断搅拌,反应约 15 min后过滤。滤液在80℃经蒸发、浓缩,冷却至10℃后析出FeSO4·7H2O晶体。
(1)若加入的废铁不是粉状而是块状,对反应的影响是 。
A.会降低反应速率 B.会减少绿矾产量
C.需要加热才反应 D.将增大反应体系的PH值
(2)反应 15 min后过滤,其目的是 。
(3)滤液中除 FeSO4和可能未反应完全的H2SO4外,最可能存在的无机杂质是 。它是由 而产生的,其检测的方法是 。
(4)设 H2SO4与铁完全反应,当将滤液蒸发浓缩后,冷却至 500C时,溶液的体积约为50.0 ml,该溶液是否达饱和?试通过计算加以说明。(500C时,FeSO4饱和溶液的密度为1.36 g/cm3)
(5)若要计算在800C下将溶液蒸发至体积为70.0 ml,再冷却至100C时,所得到的FeSO4 ·7H2O的质量,你认为_ (填编号),并简述所选之理由。答: .
A.前面提供的数据已经足够
B.还需要提供 100C时饱和溶液的密度: 1.42 g/cm3
C.还需要提供 800C时溶液的密度:1.30 g/cm3
D.还需要提供结晶后剩余溶液的体积:52.0 ml
(6)根据第(5)小题你的选择项(如选A则直接计算,如选B、C或D则可选用其数据)计算从100C 50.0 ml溶液中结晶析出的FeSO4·7H2O的质量。(本大题计算结果保留3位有效数字)
26、有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X、Y、Z。已知X是由a和b元素按原子个数比为1:1组成的化合物。
23、按如图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是 ( )
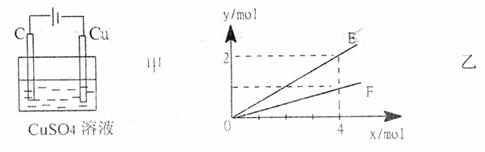
A.E表示生成铜的物质的量 B.E表示反应消耗水的物质的量
C.F表示生成硫酸的物质的量 D.F表示反应生成氧气的物质的量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com