
题目列表(包括答案和解析)
3.关于原电池和电解池的叙述正确的是 ( )
A.原电池失去电子的电极称为阴极
B.电解池的阳极、原电池的负极都发生氧化反应
C.原电池的两极,一定要由活动性不同的两种金属组成
D.电解时电解池的阳极一定是阴离子放电
2.下列过程需要通电才可进行的是:①电离②电解③电镀④电泳⑤电化腐蚀。 ( )
A.①②③ B.②③④ C.②④⑤ D.全部
1.钢铁暴露在潮湿的空气中会发生析氢腐蚀或吸氧腐蚀,发生吸氧腐蚀时正极反应式为( )
A.4H++ 4e-= 2H2↑ B.2H2O+O2+ 4e一 =4OH-
C.2Fe一 4e- =2Fe2+ D.4OH一-4e一=2H2O+O2↑
26.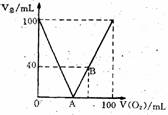 (本小题共12分) 已知H2S在O2足量的条件下燃烧生成SO2和水、在O2不足的条件下燃烧生成S和水。现标准状况下。将100mLH2S和O2的混合气体点燃,恢复到原来状况。发现随混合气体中O2所占体积V(O2)的变化,反应后所得气体总体积V(总)也在变化,如右图所示。(1)写出A、B两点横坐标值及化学方程式:
(本小题共12分) 已知H2S在O2足量的条件下燃烧生成SO2和水、在O2不足的条件下燃烧生成S和水。现标准状况下。将100mLH2S和O2的混合气体点燃,恢复到原来状况。发现随混合气体中O2所占体积V(O2)的变化,反应后所得气体总体积V(总)也在变化,如右图所示。(1)写出A、B两点横坐标值及化学方程式:
A点值_______,
A处方程式____________________________;
B点值_______,
B处方程式____________________________。
(2)填表(气体体积单位:mL)
|
V(总) |
V(O2)范围值 |
V(总) 中气体成分 |
|
①大于40 |
|
|
|
|
|
|
|
②小于40 |
|
|
|
|
|
|
|
③等于40 |
|
|
|
|
|
25. (本小题共10分) 将一定量的氯酸钾和高锰酸钾的固体混合物充分加热,得到1792mL气体(标况)。将剩余的固体分离(不考虑损耗),所得的黑色固体在强酸性条件下正好把分离得到的氯化物全部氧化。问原混合物中氯酸钾和高锰酸钾各多少克?
24.(本小题共6分) 在一定条件下, 下列各物质可发生如下图所示的变化(反应中生成的水没有写出)
过量F
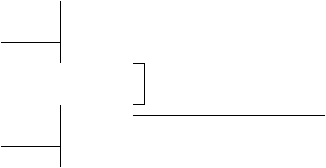 →溶液C → 溶液B → 焰色反应黄色
→溶液C → 溶液B → 焰色反应黄色
液体x (I)
固体A
→气体D 液体x
→ H → 溶液E
→气体F ↑
E溶液 溴水(II) ↓
固体B 溶液L
→溶液G
请回答:
(1)固体A是(写化学式)__________________________
(2)反应(I) 的化学方程式 ________________________________________
(3)反应(Ⅱ) 的化学方程式 ________________________________________
23.(本小题共10分)
通Cl2 通空气 用Na2CO3溶液吸收Br2 稀硫酸
 海水 → →
→ NaBr和NaBrO3溶液 → Br2
海水 → →
→ NaBr和NaBrO3溶液 → Br2
① ② ③ ④
(1)写出步骤①、③、④的离子方程式________________________________
______________________________________,_________________________________
(2)经步骤④后,从溶液中获得纯溴的方法是_________________________。
(3)若海水中c(Br-)=2 × 10-3mol/L则理论上每 lm3海水(ρ=1g/cm3)能制得_________g溴。
22.(本小题共11分) 氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,产生比它的酸性更强的含氧酸,同时放出气体,该气体混合物经干燥后,平均分子量为47.6,它可以使带火星的木条复燃,并可使润湿的淀粉一碘化钾试纸变蓝后又褪色。试完成下列各题:
(l)该气体的组成是___________,气体混合物的物质的量比为_______________。
(2)写出氯酸分解方程式并配平______________________________________________。该反应的还原产物是_________________________(写化学式)。
(3)结合化学反应方程式解释,该气体使润湿的淀粉一碘化钾试纸变蓝后又褪色的原因:
______________________________,____________________________________。
21. (本小题共9分)(1)用过量的锌与浓 H2SO4反应,某同学认为除了生成SO2外,还有H2产生。理由是____________________________________________________________。
(2)用过量的铜片与0.2mol浓H2SO4共热足够长时间(只考虑铜与H2SO4反应,忽略其它副反应)。甲认为产生的SO2等于0.1mol,理由是______________________________,
而乙同学认为产生的SO2小于0.1mol,理由是__________________________________。
你认为______同学正确。
(3)工业制取CuSO4不是直接用铜和浓H2SO4反应,而是将Cu和少量Ag的混合物漫在稀H2SO4中,并不断从容器下部吹入细小的空气泡,这样做的优点是________
①不产生污染大气的SO2②提高H2SO4的利用率③节省能源④提高铜的利用率
20.(本小题共10分) 过氧化氢(H2O2)又称双氧水,也称其为绿色氧化剂。为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化成固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有 Na2CO3和 H2O2的双重性质。“醇析法”的生产工艺过程如下:
在0-5℃下,往饱和的Na2CO3溶液中,先加入H2O2和稳定剂(MgC12和Na2SiO3)经充分反应后,再加入异丙醇,过滤分离,即得过碳酸钠晶体。根据以上材料,回答下列问题:
(1)写出H2O2的结构式:_______________。
(2)H2O2被称为绿色氧化剂的主要原因是____________________________________。
(3)稳定剂能反应生成难溶物将过碳酸钠粒子包裹住,写出稳定剂反应生成难溶物的化学方程式:_____________________________________________
(4)加入异丙醇的作用是____________________________________。
(5)下列物质不会使过碳酸钠失效的是______________________。
A. MnO2 B.NaHCO3 C.H2S D.CH3COOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com