
题目列表(包括答案和解析)
1.根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的 ( )
A.溶液 B.悬浊液
C.乳浊液 D.胶体
26. (本小题共10分) 电解含重水(D2O) 的水, 得到H2 、HD 、D2的混和气体, 现有1L含重水0.017%(质量分数) 的水, 设其密度仍为1 g/cm3, 将其完全电解后,分离得到HD、D2的混和气体,其平均相对分子质量是3.5,试计算 HD、D2混和气体的各体积(标准状况下)?
25.(本小题共9分) 第ⅣA族元素R, 在它的化合物R(OH)n中,其质量分数是0.778, 在它的另一种化合物R(OH)m中,其质量分数是0.636。
(1)试求n和m的值: n=______________, m=____________。
(2)试求R的相对原子质量M( R)=____________ 。
|
(1)A、D的电子式分别为:A____________,D_______________。
(2)B、C、D三种微粒结合质子能力x>y>z,(x、y、z分别代表B、
C、D中的某一种微粒),则x、y、z分别代表的微粒符号为x________,
y__________,z________
(3)请分别用离子方程式说明结合质子能力x>y>z的判断依据:
x>y:___________________________________________
y>z:___________________________________________
24.(本小题共10分) A、B、C、D、E、F六种短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
|
|
甲 |
乙 |
丙 |
丁 |
戊 |
|
化合物中各元素的原子个数比 |
A:C=1:1 |
B:A=1:2 |
D:C=1:1 |
E:F=1:3 |
B:F=1:4 |
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D与A同主族;E与F的原子序数之和为30;丙是离子化合物。
(l)F元素位于周期表中第___周期___族;E离子结构示意图是____;丙的电子式是_____。
(2)向甲的水溶液中加入MnO2,反应的化学方程式为__________________________。
(3)丁的水溶液与NaHCO3溶液混合会生成气体和沉淀,反应的离子方程式为
_______________________________________________________。
22. (本小题共11分) 致冷剂是一种易被压缩、液化的气体(致冷剂分子一般是①式量_____,或②分子之间存在______键),液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3,CH3Cl等作致冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的致冷剂。据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:
第二周期 _______>_______>H2O>HF; 第三周期SiH4>PH3>________>________。
(2)化合物的毒性:
PH3>NH3 H2S______H2O;CS2_______CO2 CCl4>CF4(以上选填>或<=)
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CCl2F2终于诞生了,其它类似的还可以是________(举一例)
(4)然而,这种致冷剂造成了当今的某一环境问题是__________________。但求助于周期表中元素及其化合物的_____________变化趋势来开发致冷剂的科学思维方法是值得借鉴的。(后一空格选填字母) ①毒性②沸点③易燃性④水溶性⑤颜色
A.①②③ B. ②④⑤ C.②③④
21. (本小题共8分) 某书本查得相对原子质量数据摘录如下:
(本小题共8分) 某书本查得相对原子质量数据摘录如下:
|
35Cl |
34.969 |
75.77% |
35Cl |
35 |
75.77% |
|
37Cl |
36.966 |
24.23% |
37Cl |
37 |
24.23% |
|
|
35.453 |
|
|
35.485 |
|
(1)34.969表示_________________________ (2)35表示_________________________
(3) 35.453表示_____________________(4) 得35.485的计算式是______________________
20.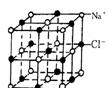 (本小题共13分) 右图为氯化钠晶体结构。
(本小题共13分) 右图为氯化钠晶体结构。
(1)晶体中,每个Na+周围有____个Cl-,每个Cl-周围与它最接近且距离相
等的Cl一共有_____个。
(2)在NaCl晶体中,与Na+距离等同且最近的几个Cl一所围成的空间几何
构型为_____(填序号)
A. 正四面体 B. 正六面体 C.正八面体 D.正十二面体
(3) 若Na+ 、Cl-的最近距离是a cm, 则氯化钠晶体的密度是_____________
(4)
若用实验方法测定氯化钠晶体的密度, 根据ρ=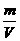 ,利用_________________(填仪器名称)测得氯化钠晶体质量m ;将该晶体小心放入一量筒中,
用______式滴定管滴加_______(选填下列试剂), 量筒读数V1 , 滴定管前读数V2, 滴定管后读数V3, 则V=__________(填V1 、V2、V3代数式)。
,利用_________________(填仪器名称)测得氯化钠晶体质量m ;将该晶体小心放入一量筒中,
用______式滴定管滴加_______(选填下列试剂), 量筒读数V1 , 滴定管前读数V2, 滴定管后读数V3, 则V=__________(填V1 、V2、V3代数式)。
A.水 B.四氯化碳 C.汽油 D.硝酸银溶液
19. (本小题共8分)用原子结构理论解释钠、镁、铝的还原性强弱。并用实验确认之,除钠块、镁片、铝片外还可选用的试剂有①HCl②HNO3③蒸馏水④酚酞试液。
18.某离子R2+的最外层有2个电子,且有5个电子层,当固体RCl2溶于水配成溶液时,需加入少量单质R和盐酸。由此推断下列叙述正确的是 ( )
A.R为IIA族元素
B.R的最高价氧化物的水化物是强碱
C.R2+的硝酸盐的水溶液呈酸性
D.RCl2具有还原性,容易进一步被氧化
第II卷 (非选择题满分78分)
17.英国科学家发现的C60是一种新的分子,它具有空心的类似足球的结构,被称为”分子足球”。最近日本科学家确认世界上还存在着另一种“分子足球N60”,它与C60的结构相似所且在高温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。对于 N60,下列说法正确的是 ( )
A.N60是由共价键构成的交心圆球面结构,所以它是一种原子晶体
B.N60没有同素异形体
C.N60与14N都是氮的同位素
D.N60将来可能成为非常好的火箭材料
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com