
题目列表(包括答案和解析)
1.现有下列物质:①氯水、②氨水、③浓硝酸、④溴,其中必须保存在棕色瓶里的是
A.全部 B.①③和⑤
C.只有①和③ D.①②和④
29.(6分)工业上从铝土矿(含氧化铝、氧化铁等)制取铝的流程如图所示:
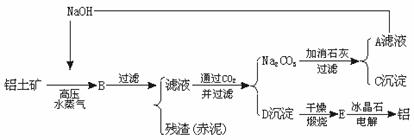
经分析,生产原料(铝土矿)和提取Al2O3后的残渣(赤泥)的部分成分见下表(以氧化物表示)。已知铝土矿中的Fe2O3全部转入赤泥。
|
|
Al2O3 |
Fe2O3 |
Na2O(由NaOH折算成Na2O) |
|
铝土矿 |
55% |
16% |
0% |
|
赤泥 |
15% |
48% |
8% |
(1)生产中每消耗1 t铝土矿将产生多少t赤泥?
(2)试计算出每炼1 t铝,理论上需要多少t铝土矿?应补充多少t NaOH?
28.(6分)已知亚铜离子在酸性条件下能自身氧化还原为Cu2+和Cu,现由氧化铁和氧化亚铜组成的试样,将其等分为X和Y,如图实验:
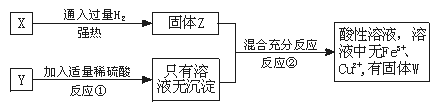
(1)写出①中发生反应的离子方程式_________________。
(2)写出②中发生反应的离子方程式_________________。
(3)原试样中氧化铁和氧化亚铜的物质的量之比为________________________。
27.(10分)碱式碳酸镁有多种不同的组成,如Mg2(OH)2CO3、Mg4(OH)2CO3、Mg5(OH)2(CO3)4等。
请你设计一个测定碱式碳酸镁组成的实验方案。包括①测定原理 ②测定实验的装置图 ③操作步骤。
可使用的仪器、试剂和用品如下:
仪器:天平(附砝码)、大试管(附带有短玻璃管的橡皮塞)、酒精灯、洗气瓶、球形干燥管(附带有短玻璃管的橡皮塞)、铁架台、铁夹、角匙。
试剂:碱式碳酸镁(粉状)、浓硫酸、石灰水、无水氯化钙、碱石灰。
其他:火柴、棉花、短橡皮管、弹簧夹。
注意:①上述仪器和试剂只需应用其中的一部分。
②仪器、试剂、用品的数量不限。
26.(7分)砖瓦是含铁元素等杂质的粘土隔绝空气烧制而成的,当烧窑作业临近结束时,若用淋洒水的办法来降低温度,窑内处于还原性气氛,砖块中的铁以氧化亚铁的形式存在,因而砖呈青色。若用捅开窑顶自然冷却的办法,砖就变成了红色。
(1)从化学角度看,砖瓦呈红色的原因是_____________________________________。
(2)现有一块红砖,实验台上有:浓硫酸、3 mol·L-1盐酸、0.1 mol·L-1硫氰化钾溶液、0.1 mol·L-1氯化铁溶液、0.01 mol·L-1氢氧化钠溶液、蒸馏水等试剂,请选用中学化学常用仪器,设计一个实验,用最简捷的方法验证红砖中含有三价铁(简述实验步骤、所用仪器、产生现象、所得结论)。
25.(8分)甲、乙两位学生用两种不同方法制取氮气,并测定氮气的相对分子质量(用密度法)。下面是甲、乙两位学生提出的两种制备氮气的实验方案(箭头表示气体的流向)。
甲:空气→碱石灰→红磷(点燃)→水→铜粉(灼热)→集气瓶
乙:NH4NO2(加热)→浓硫酸→镁粉(灼热)→集气瓶(NH4NO2 N2↑+2H2O)
N2↑+2H2O)
回答下列问题:
(1)甲、乙两位学生的实验方案是否能制氮气?甲_________、乙_________(填“能”或“不能”)。
(2)具体说明不能制取氮气的原因并纠正(若两种方案都能制氮气,此小题不用回答)_____________________________________。
(3)甲、乙方案中碱石灰和浓H2SO4可否交换位置?说明理由:______________________________________________________________。
(4)甲、乙两位学生按正确装置制取的氮气,用密度法测出相对分子质量(精确到0.001),进行比较:M(甲)_________________M(乙)(填“<”或“=”或“>”)。
24.(8分)有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、NO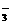 、SO
、SO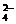 、Cl-、I-、HCO
、Cl-、I-、HCO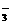 ,取该溶液实验如下:
,取该溶液实验如下:
|
实验步骤 |
实验现象 |
|
①取少量该溶液,加几滴甲基橙 |
溶液变红色 |
|
②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,后在空气中又变成红棕色 |
|
③取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
|
④取③中上层清液,加AgNO3溶液 |
有白色沉淀生成,且不溶于HNO3 |
|
⑤取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是________________________。
(2)溶液中肯定不存在的离子是________________________。
(3)为进一步确定其他离子,应该补充的实验是_________________。
23.(7分)某学生将混有铜粉的氯化铁晶体(FeCl3·6H2O)提纯,以得到纯净的氯化铁晶体,他提出了下列实验步骤:
a.把样品溶解;b.过滤除去铜粉;c.蒸干溶液即得到氯化铁晶体。
(1)以上实验步骤是否可行?_________________,其原因是什么?(要写出有关的化学方程式)。
(2)请拟出合理的实验方案(只写简单步骤):
①________________________,②________________________,③_________________,④________________________,⑤_________________,⑥_________________。
22.(4分)第3周期金属元素A和B,A单质与适量盐酸反应,B单质与适量稀硫酸反应,分别生成V(A) L和V(B) L H2(同温、同压时测定),且V(A)≠V(B),若要确定A、B的化合价,至少需要知道的数据是________________________。
21.(4分)在金、铜、铁、钠、钾、镁、铝几种金属中,属于轻金属的有_________________;导电性能最好的是__________________;硬度最大的是__________________;熔点最高的是_______________;在空气中最稳定的是_______________;最活泼的是_______________;常温时与水能剧烈反应的有____________________________;既能跟酸反应,又能跟碱溶液反应的是______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com