
题目列表(包括答案和解析)
8.某溶液中含有Ag+、Ba2+、Mg2+离子,为了将这三种离子逐个进行沉淀分离,加入下列离子的先后顺序正确的是
A.CO32-、Cl-、OH- B.Cl-、OH-、CO32-
C.OH-、Cl-、CO32- D.CO32-、OH-、Cl-
7.近年来,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不妥当的是
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效催化剂,使SiO2分解产生硅同时释放能量,是硅能源大规模开发利用的一项关键技术
6.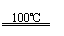
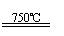 根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
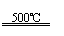
 ①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2↑
①CaBr2+H2O CaO+2HBr ②2HBr+Hg HgBr2+H2↑
③HgBr2+CaO HgO+CaBr2 ④2HgO 2Hg+O2↑
该方案的目的是为了制备
A.HBr B.CaO C.H2 D.Hg
5.近年来用红外激光技术研究液氢时,发现分子间作用力也可引起粒子间的反应。在液氢
中有氢分子和质子形成的H3+离子,其构型是等边三角形;H3+还可进一步形成Hn+。下列
判断正确的是
A.H3+可在液氢中开成H5+、H7+、H9+ B.每个H3+粒子中含有2个质子
C.H3+可在液氢中形成H4+、H5+、H6+ D.H3+可广泛存在于固态、液态和气态氢中
4.2003年2月1日美国哥伦比亚号航天飞机在空中解体失事,有专家分析认为,飞机空中解体的最大可能原因是航天飞机机壳底部的石墨瓦在空中脱落,击中机翼。航天飞机表面覆盖石墨瓦,主要是利用石墨
A.具有导电性、防辐射 B.密度小,减轻机身重量
C.熔点高、化学性质稳定 D.硬度小,有润滑作用
3.下列各组中的物质相互作用,水既不是氧化剂,又不是还原剂,且反应属于氧化-还原
反应的是
A.氟气与水 B.铝与氢氧化钠溶液
C.二氧化氮与水 D.五氧化二磷与冷水
2.下列物质露置于空气中易变质的是
①氯水 ②水玻璃 ③烧碱 ④漂白粉 ⑤绿矾 ⑥亚硫酸钠
A.除⑤外 B.除②③外 C.除②③⑥外 D.全易变质
1.我国“神舟五号”航天飞船成功发射升空,表明我国的载人航天技术已经有了突破性的进展。在运送飞船的某些火箭推进器中盛有液态肼(N2H4)和液态双氧水,它们充分混合反应后的产物之一是
A.氧气 B.氮气 C.氨气 D.氢气
|
|
|
第一份 |
第二份 |
第三份 |
|
样品的质量/g |
12.60 |
18.90 |
28.00 |
|
二氧化硫的体积/L |
1.12 |
1.68 |
2.24 |
|
硫的质量/g |
1.28 |
1.92 |
2.56 |
(1)样品与硫酸可能发生反应的离子方程式为 。
(2)根据上表数据分析,该样品 (填选项字母)
 A.只含有Na2S2O3
A.只含有Na2S2O3
B.含有Na2S2O3和Na2SO3两种成分
C.含有Na2S2O3、Na2SO3和Na2SO4三种成分
(3)试计算:该样品中各成分的物质的量之比。
(4)求所加硫酸溶液的物质的量浓度是多少?
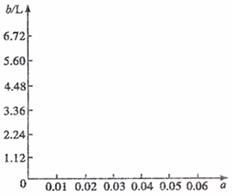
(5)若将63 g该样品与一定量的该硫酸溶液微热,欲计算生成SO2的体积,还需要提供的一个数据是(用a表示该数值,并注明单位) 。
试讨论:当a在不同取值范围时,SO2的体积b.并请在图上画出b随a变化的曲线。
23.(10分)氮化铝是一种新型的无机非金属材料,被广泛应用于集成电路生产领域。其制备反应原理为:Al2O3+N2+3C 2AlN+3CO。制备过程中,原料配比不当或反应不完
全等因素都会造成产品中含有碳或Al2O3等杂质。为测定产品中AlN的质量分数,某同
学按下图装置进行相关实验。可选用的化学试剂为:
 氮化铝片状固体、NaOH饱和溶液、水、煤油、医用酒精。
氮化铝片状固体、NaOH饱和溶液、水、煤油、医用酒精。
 回答下列问题:
回答下列问题:
(1)简述检查该套装置气密性的方法
。
(2)右图B中试剂最好选用(填序号):
。
①水 ②煤油 ③医用酒精
已知A 中有NaAlO2生成,并放出有刺激性气味气体,写出A中发生反应的化学方程式
。
(3)读取C(量筒)中液体体积时,应注意 。(填序号)
a.C中液面不再上升时立即读数 b.上下移动C,使之液面与B中液面相平
c.A中不再有气泡逸出 d.视线与凹液面最低处相平
(4)mg氮化铝与足量NaOH饱和溶液反应,实验结束后,C中收集到液体的体积为VL(已折算成标准状况),则AlN样品的纯度为 (写计算表达式)。
(5)上述实验方案,可能因气体体积测量不准,导致误差较大。有人建议改用下列A、B两个装置中的一种(在通风橱内进行),只需进行简单而又必要的数据测写,用差量法就
 可比较准确确定样品中AlN的质量分数。较合理的装置是:
(填代号)。
可比较准确确定样品中AlN的质量分数。较合理的装置是:
(填代号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com