
题目列表(包括答案和解析)
4.某金属硝酸盐受热分解生成金属氧化物、二氧化氮和氧气。若生成的二氧化氮和氧气的物质的量之比为8∶1,则金属元素的化合价在反应过程中的变化是
A.升高 B.降低 C.不变 D.无法确定
3.工业上利用下述反应在真空中炼铷:2RbCl+ Mg==MgC12+2Rb。这一反应能进行的原因是
A.在高温下镁的金属活泼性比铷强
B.铷的沸点比镁低,以气体形式被抽去
C.铷的熔点比镁低,以液体形式被抽去
D.MgC12的稳定性比RbCl的强
2.2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是
A.单质钠的密度比钾的密度小 B.钠和钾在空气中燃烧的产物都是过氧化物
C.钠和钾都是短周期元素 D.钠和钾的合金[ω(K)=50%-80%]在室温下呈液态
1.下列物质相互反应能产生可燃性气体的是
①炭块投入浓硝酸中②铁片投人稀硫酸中③过氧化钠投入水中④电石投入食盐水中
A.①③ B.②④
C.①④ D.②③④
24.(8分)CuSO4溶液和强碱反应得碱式硫酸铜,其化学组成为aCuSO4·bCu(OH)2(a、b为正整数,且2<b<6,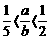 ),有的还含一定数目的结晶水,其组成随反应条件不同而
),有的还含一定数目的结晶水,其组成随反应条件不同而
异。
(1)取一种不含结晶水的某碱式硫酸铜样品高温灼烧后只得CuO固体,另取等质量的样品,滴加稀盐酸至恰好完全反应。两次实验中消耗HCl与生成CuO的物质的量之比为3:2,则该碱式硫酸铜的化学组成为__________________。
(2)某含结晶水的碱式硫酸铜aCuSO4·bCu(OH)2·cH20(c也是正整数),已知a+b+c=9。
取一定量样品高温灼烧至质量不再改变,将反应产生的气体通过盛有足量P2O5的U型管,U型管增重1.26g。残留固体冷却后质量为5.60g。通过计算求该含结晶水的碱式硫酸铜的化学组成。
23.(12分)为检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图11所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。

请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是
;
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是 (用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水b;
(3)实验时,装置C中的现象为 ;
(4)当D中产生 (多选不得分)现象时,可以说明使E中澄清石灰水变浑的的CO2,而不是SO2;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
则装置D的作用为
22.(6分)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应。又知E溶液是无色的。
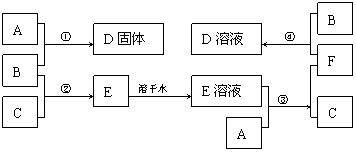
请回答:
(1)写出A、B、C的化学式。
A: B: C:
(2)反应①的化学方程式为:
(3)反应③的化学方程式为:
(4)反应④的离子方程式为:
21. (8分)某厂废液中含有大量Ag+、Fe3+、Al3+,用下列图示方法进行分离(部分反应条件省略):
(8分)某厂废液中含有大量Ag+、Fe3+、Al3+,用下列图示方法进行分离(部分反应条件省略):
(1)写出下列物质的化学式:
试剂x 、试剂z 。
晶体E 、固体G 。
(2)写出下列反应的离子方程式:
沉淀A+试剂y: 。
滤液D+过量CO2: 。
20.(9分) 氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,产生比它的酸性更强的含氧酸,同时放出气体,该气体混合物经干燥后,平均相对分子质量为47.6,它可以使带火星的木条复燃,并可使润湿的淀粉一碘化钾试纸变蓝后又褪色。试完成下列各题:
(l)该气体的组成是___________,气体混合物的物质的量比为_______________。
(2)写出氯酸分解方程式并配平________________________________________。该反应的还原产物是_________________________(写化学式)。
(3)结合化学反应方程式解释,该气体使润湿的淀粉一碘化钾试纸变蓝后又褪色的原因:______________________________,____________________________________。
19.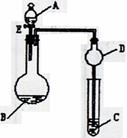 (11分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(11分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(1)图中D装置在实验中的作用是 .
(2)若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸
(H2S)饱和溶液,旋开E后,C中的现象为 ,
C中发生反应的化学方程式为 。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,
旋开E后,C中的现象是 ;继续通气体于C中,
足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液
中I2能被Cl2氧化为HIO3,写出该反应的化学方程式 。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是 ,C中发生反应的方程式为 。
(5)该题图示装置有多种用途,请举一例(除题中之外)填空:A为 ,B为 ;C中盛 ,其目的为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com