
题目列表(包括答案和解析)
1.某微粒用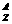 R
R 表示,下列关于该微粒的叙述正确的是
表示,下列关于该微粒的叙述正确的是
A、所含质子数=A―n B、所含的中子数=A―Z
C、所含的电子数=Z+n D、质量数=Z+A
0.10mol·L-1Na2S2O3溶液滴定,I2+2S2O32-=2I-+S4O62-,消耗了40 mLNa2S2O3溶液,
计算:
(1)原饱和溶液中Cu(IO3)2的物质的量浓度。
(2)若Cu(IO3)2饱和溶液的密度为1.0g·cm-3,室温时Cu(IO3)2的溶解度是多少?
|
 Al2O3+N2+3C 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂
Al2O3+N2+3C 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂
质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液
反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①上述反应的化学方程式为:
②该样品中的AlN的质量分数?
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后
测得气体的密度为1.34g·L-1(已折算成标准状况,AIN不跟O2反应)。该样品中
含杂质炭的质量为多少?
24.(8分)在室温下,向100mL Cu(IO3)2饱和溶液中加入足量的经酸化的KI溶液,发生如
下的反应:5I-+IO3-+6H+=3I2+3H2O 2Cu2++4I-=2CuI↓+I2反应完全后,用
23.A、B、C、D、E、F为原子序数依次增大且原子序数均大于10的主族元素。已知A、C、
F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能
反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子
次外层电子数比最外层电子数多3。回答:
(1)写出下列元素的符号:A 、D 、E ;
(2)写出B、F形成的化合物的电子式 ;
(3)A、C两种元素最高价氧化物的水化物反应的离子方程式为:
(4)D的固态氧化物是 晶体,含n mol D的氧化物的晶体中含D-O共价健
为 mol。
22.实验室要用98%(ρ=1.8g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL
(1)需准确量取98%的硫酸 mL。
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须
用到的实验仪器是(填写序号):
①500mL量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶 ⑤天平
⑥胶头滴管 ⑦锥形瓶 ⑧玻璃杯 ⑨酸式滴定管
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所
配制的硫酸溶液浓度偏低的是 。
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶
内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。
(4)若配制时,因加水不慎略超过了容量瓶刻度线,此时实验应如何继续进行?
答:
21.(6分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
。
若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+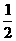 O2(g)=H2O
O2(g)=H2O
(1)的△H= kJ·mol-1
20.(14分)阳离子Na+、Ag+、Mg2+、Cu2+和阴离子Cl-、NO3-、OH-、SO42-两两组成(不
重复)A、B、C、D四种可溶性化合物,它们起反应时的现象如下:
A+B→白↓, B+D→白↓,C+D→蓝↓
由此判断:A ,B ,C ,D 。(写化学式)
上述生成沉淀的离子方程式为:(1) ,
(2) ,
(3) 。
19.(10分)氯、溴、碘同属于周期表中的VII A族,在上个世纪,人们很早就制得高碘酸
及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2(二氟化氙)
和KBrO3首先制得BrO4-,不久得到纯净KBrO4晶体。
(1)已知XeF2与水反应生成O2和氙气,氟则以化合态留在水溶液中,每生成1molO2,
转移电子数 mol。该反应的氧化剂是 。
(2)写出XeF2和含KOH、KBrO3的水溶液反应得到KBrO4的离子方程式是
。
(3)根据上面的信息,指出BrO4-的稳定性与pH的关系 。
18.在一定条件下,硫酸铵的分解反应为:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,
当有mmol电子转移时,下列说法不正确的是 ( )
A.有2nmol(NH4)2SO4分解 B.有 原子被还原
原子被还原
C.生成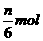 氧化产物 D.生成7nmolH2O
氧化产物 D.生成7nmolH2O
第Ⅱ卷(78分)
17.某结晶水合物的化学式为R·nH2O,其式量为M,25℃时将ag该晶体溶于bg水中达到
饱和,并得到VmL溶液,下列表达式正确的是 ( )
A.饱和溶液的物质的量浓度为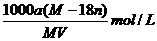
B.饱和溶液的溶质的质量分数为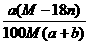
C.25℃时R的溶解度为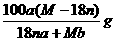
D.饱和溶液的密度为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com