
题目列表(包括答案和解析)
20.(13分)如图中每一方框中的字母代表一种反应物或生成物。已知A、B、C、D均为前三周期元素的单质,也是中学化学常见的物质。其中A、B为固体,且B是良好的半导体材料;C、D为气体。电解H的饱和溶液生成X、C和D,此反应是一个重要的化工反应。(物质间相互转化时水已略去)
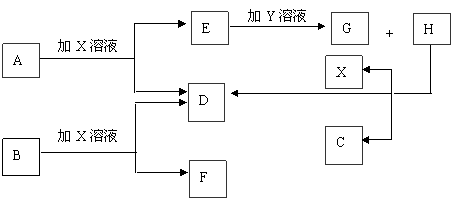
请填空:
(1)写出下列物质的化学式:
A C X 。
(2)B单质为 晶体(填晶体类型)
(3)E和G在水溶液中混合反应的离子方程式为 ;
(4)25℃时,用石墨电极电解含0.4molH物质的水溶液,在阳极产生0.1mol气体,测得此
时溶液体积为200mL,则此时该溶液的pH约为 。
19.(6分)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu==2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-==Cu2+;还原反应为:2Fe3++2e-==2Fe2+。
(1)请据此将反应3NO2+H2O==2H++2NO3-+NO拆写为两个半反应式。
氧化反应___________________________________________;
还原反应___________________________________________。
(2)已知某一反应的半反应式CH4+10OH- -8e-==CO32-+7H2O,O2+2H2O+4e-==4OH-。
则总方程式为 。
18. (12分)NH4Cl和C2H5Br都能与水发生水解反应,反应中H2O分子按两种方式离解:
a离解成氢离子(H+)和氢氧根离子(OH-)
b离解成氢原子(H)和羟基(-OH)
(1)NH4Cl水解的化学方程式 ,
水的离解方式 (填字母代号,下同);C2H5Br水解化学方程式
,水的离解方式 。
(2)Mg4C3的水解按“a”式进行,化学方程式 。
(3)PCl3的水解按“b” 式进行,化学方程式 。
17.(8分)在某化学实验中,有如下循环过程,试回答下列问题:
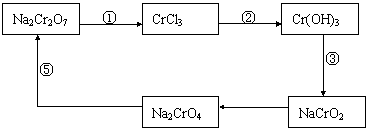
(1)在上述有编号的步骤中,需要还原剂的是 ,需要氧化剂的
是 (填编号)
(2)在上述循环中,既能与强酸反应又能与强碱反应的物质是 (填化学式)。
(3)请配平下列反应的化学方程式。
□Na2CrO7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□H2O
16.
 下图为一些常见仪器的部分结构:(7分)
下图为一些常见仪器的部分结构:(7分)
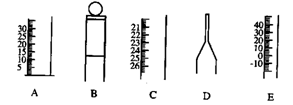
(1)请写出仪器名称:A B C D E
(2)检查B是否漏水的方法是
。
第二卷(满分55分)
15.在常温下,有两种稀氨水,它们物质的量浓度、氢离子浓度、氢氧根离子浓度、pH分别为c1、c2,c(H+)1、c(H+)2,c(OH-)1、c(OH-)2,pH1、pH2。已知:pH1=pH2+1,则下面的关系正确的是
A、c1:c2=10:1 B、c(OH-)1:c(OH-)2 =2:1
C、c(H+)1:c(H+)2 =1:10 D、c1<c2
14.向Cr2(SO4)3的水溶液中加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着
pH的升高,沉淀增多,但当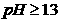 时,沉淀消失,出现亮绿色的亚铬酸根CrO2-。
时,沉淀消失,出现亮绿色的亚铬酸根CrO2-。

 其平衡关系如下:Cr3++3OH- Cr(OH)3 CrO2-+H++H2O
其平衡关系如下:Cr3++3OH- Cr(OH)3 CrO2-+H++H2O
(紫色) (灰绿色) (亮绿色)
向0.05mol/L的Cr2(SO4)3溶液50mL中加入1.0mol/L的NaOH溶液50mL,充分反应后,
溶液中可观察到的现象为
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
13.从20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子,但一直没有得到证实。最近,意大利一所大学的科学家使用普通的氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它存在的证据,若该氧分子具有空间对称结构,你认为该氧分子是
A、氧元素的一种同位素 B、臭氧的同分异构体
C、一种新的氧化物 D、可能是非极性键构成的非极性分子
12. 在某未知溶液中,溶入醋酸钠晶体后,测得c(Na+)和c(CH3COO-)之比接近1:1,则对原溶液判断正确的是
A、不可能是碱性溶液 B、可能是强酸性溶液
C、原溶液中一定不含有CH3COO-
D、原溶液中可能已有CH3COO-,且c(Na+):c(CH3COO-)<1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com