
题目列表(包括答案和解析)
1.精确地测定了铱、锗等7种元素的相对原子质量,使我国在此领域达到国际先进水平,
在化学界享有盛名的科学家是 ( )
A.葛洪 B.侯德榜 C.张青莲 D.华罗庚
32.(3分)标况下,用一定量的水吸收氨气后制得浓度为12. 0 mol/L、密度为0.915 g/cm-3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的式量以 17.0计,水的密度以1.00g·cm-3计)
(5分)为了预防碘缺乏病,国家规定每千克食盐中应含有40-50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:
IO3-+5I-+6 H+→3I2+3H2O
I2+2S2O32-→2I-+S4O62-
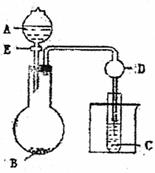
31.(11分)用下图所示装置进行实验,将A
逐滴加入B中:(1)若A为浓H2SO4,B
为第三周期金属元素的片状单质,其在常
温下难与水反应;C为品红溶液,实验中
观察到溶液褪色,则B是 (化
学式),B与浓H2SO4反应的方学方程式为
;反应后往烧杯中加入沸水,又可观察到试管C中的现象为 。
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是 。然后往烧杯中加入沸水,可观察到试管C中的现象是 。
(3)若B是生石灰、实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是 (名称),C是 与葡萄糖的混合液,仪器D在此实验中的作用是
。
30.(3分)下列操作一定会使实验结果偏高的是 .
A.用标准HCl溶液滴定未知浓度的NaOH溶液,碱式滴定管未经润洗就直接取20mLNaOH溶液
B.用冷却结晶法测定不同温度下的KNO3的溶解度,没有在析出晶体时立即读温度计的读数
C.用加热法测定CuSO4晶体中结晶水的含量,坩埚不干燥,且加热不充分
D.
 配制一定物质的量浓度NaOH溶液,定容时仰视容量瓶液面
配制一定物质的量浓度NaOH溶液,定容时仰视容量瓶液面
E. 在中和热的测定实验中,准确量取0.5mol/L的NaOH溶液100ml和10mol/L的H2SO4溶液5ml在保温性好的量热器中进行。
29.(4分)用24.5的H2SO4溶液(ρ=1.20g/cm2)配制100mL0.20mol/LH2SO4溶液时,要用到的玻璃仪器有:容量瓶、酸式滴定管、烧杯、量筒、玻璃棒和 。使用容量瓶时应先检查其是否 ;用 量取 mL24.5%硫酸溶液进行配制。
28.(7分)拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去,必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
|
气体 |
a |
b |
c |
d |
|
C2H4 |
C2H5OH |
浓H2SO4 |
NaOH溶液 |
碱石灰 |
|
Cl2 |
浓HCl |
KMnO4 |
饱和NaCl溶液 |
浓H2SO4 |
|
H2S |
稀HNO3 |
FeS |
饱和NaHS溶液 |
无水CaCl2 |
|
NO2 |
浓HNO3 |
Cu |
H2O |
P2O5 |
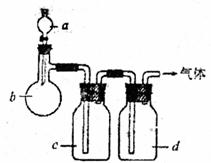 (1)上述方法中可以得到干燥、纯净的气体是 。
(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体 ,理由是 。
②气体 ,理由是 。
③气体 ,理由是 。
④气体 ,理由是 。
27.(6分)如图所示
 已知:①甲、乙、丙、丁均为前三周期元素的单质。
已知:①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比
1︰3反应,分别生成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比
1︰2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)甲是 ,乙是 。
(2)甲与丙反应生成X的化学方程式是
(3)乙与丁反应生成W的化学方程式是
26.(5分)实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:
4CuI+Hg→Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1molCuI参与反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:
Cu2++ I-→ CuI+ I3-
25.(4分)(1)室温下,将2g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6kJ的热量,写出C6H6燃烧热的热化学方程式 。
若lg水蒸汽转化成液态水放热2.44kJ,则室温下C6H6完全燃烧生成1mol水蒸气时的燃烧热为 。
24.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是 ( )
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
班级 姓名 座号 成绩
第Ⅰ卷答题卡(选择题共52分)
第II卷(非选择题共48分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com