
题目列表(包括答案和解析)
3.下列说法正确的是
A. 放热反应在常温下一定很容易发生
B.需要加热才能发生的反应一定是吸热反应
C.人们利用化学反应只是为了制取所需要的物质
D.反应是放热还是吸热,主要取决于反应物和生成物所具有的总能量的相对大小
2.工业上生产硫酸时,吸收SO3气体使用的试剂是:
A 水 B 30%硫酸 C 98.3%硫酸 D 纯硫酸
1.将淀粉-KI混合溶液装在半透膜中,浸泡在盛有蒸馏水的烧杯中,取杯中液体进行实验,能证明半透膜有破损的是
A 加碘水变蓝色 B 加碘水不变蓝色 C 加氯水变蓝色
D. 加硝酸银溶液产生黄色沉淀
29.(10分)已知Cl2通入浓氨水中会发生如下反应:3Cl2+8NH3 6NH4Cl+N2。今有体积为1.12L质量为3.335g Cl2和N2的混合气体通过浓氨水后,体积变为0.672L[其中Cl2、N2各占50%(体积分数)]。(气体体积均在标准伏况下测定)
(1)经计算,被氧化的氨的质量为 g。(不必写出计算过程)
(2)下面是三位学生从不同角度解这道题时所列的第一步算式,请判断他们所列未知数x分别表示什么量,并填写在表格内。(为简便,单位未列出)
|
学
生 编
号 |
所
列 第
一 步
算 式 |
未知数x表示的意义 |
|
甲 |
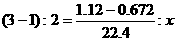 |
|
|
乙 |
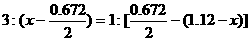 |
|
|
丙 |
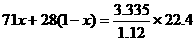 |
|
28.(10分)某石灰厂利用本地资源石灰石(所含杂质高温不分解,也不跟酸反应),在石灰窑内高温煅烧生产石灰,取煅烧后的样品5.92 g 跟25.0 mL盐酸恰好完全反应,放出44.8 mL CO2(标准状况),滤出残渣0.12 g。请计算:(1)石灰石中碳酸钙转化率。(2)盐酸中溶质的物质的量浓度。
27.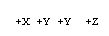 如图所示转化关系中,A是一种酸式盐,D的相对分子质量比C的相对分子质量大16。E是一种强氧化性酸,可用于配制王水。A、B、C、D、E中均含同一种元素。在含盐酸的品红溶液中加入A盐后,可使品红溶液褪色,向该溶液中加入一定量的X后,加热溶液又变红色。25℃时,0.1mol/L的X溶液的pH=13。
如图所示转化关系中,A是一种酸式盐,D的相对分子质量比C的相对分子质量大16。E是一种强氧化性酸,可用于配制王水。A、B、C、D、E中均含同一种元素。在含盐酸的品红溶液中加入A盐后,可使品红溶液褪色,向该溶液中加入一定量的X后,加热溶液又变红色。25℃时,0.1mol/L的X溶液的pH=13。
A→B→C→D→E
根据上述事实,回答下列问题:
(1)A是 ,Y是 ,Z是
(2)X可能是 (任写一种)
(3)写出D与碳酸氢钠溶液反应的化学方程式
26.(14分)长征二号火箭的主要燃料是名叫“偏二甲肼”的液体物质。此化合的相对分子质量为60。其中,含碳的质量分数为40%,氢的质量分数为13.33%,其余为氮。则:
(1)偏二甲二肼的化学式为 ,若该分子中的氮原子均以


 N 的形式存在,且其中一个氮原子直接相连,则偏二甲肼的结构简式为
N 的形式存在,且其中一个氮原子直接相连,则偏二甲肼的结构简式为
。
(2)此燃料的氧化剂是N2O4气体,若燃烧0.2mol偏二甲肼液体放出的热量为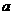 kJ(a>0)
kJ(a>0)
燃烧的产物只有N2、CO2、H2O(均为气态),则偏二甲肼燃烧的热化学方程式为
(3)火箭起飞时,一级火箭中部冒出红棕色气体,这是排出的部分氧化剂变化而来,其化学方程式为 。
25. (14分)某化学反应2A 3B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
(14分)某化学反应2A 3B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验序号 |
 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
2.0 |
1.60 |
1.34 |
1.14 |
1.00 |
1.00 |
1.00 |
|
2 |
800℃ |
C2 |
1.84 |
1.50 |
1.26 |
1.20 |
1.20 |
1.20 |
|
3 |
800℃ |
C3 |
1.20 |
1.00 |
1.00 |
1.00 |
1.00 |
1.00 |
|
4 |
820℃ |
2.0 |
0.80 |
0.50 |
0.40 |
0.40 |
0.40 |
0.40 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)设实验2的反应速率为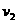 ,实验1的反应速率为
,实验1的反应速率为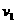 ,则
,则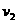
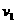 (填<、=、>)且C2 2.0 mol/L(填<、=、>)。
(填<、=、>)且C2 2.0 mol/L(填<、=、>)。
(3)在实验3,A的初始浓度C3= mol/L,反应经20分钟就达到平衡,可推测实验3中还隐含的条件是 。
(4)比较实验4和实验1,可推测该反应的逆反应是 反应(选填吸热、放热)。理由是 。
23.(1)(5分)某学生进行研究性学习,在一个月内总共需要480mL 0.5mol/L NaCl溶液。现在该学生要在实验室进行配制并保存溶液。该学生开列的实验用品为:蒸馏水、烧杯、托盘天平、砝码和玻璃棒,还缺少的必要的仪器和药品是
。
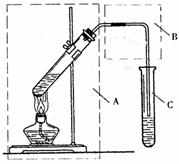 (2)(8分)用右图所示的装置,以乙酸、乙醇和浓硫酸
(2)(8分)用右图所示的装置,以乙酸、乙醇和浓硫酸
的混合为原料加热制取乙酸乙酯时,装置A部分的
作用,一是起合成乙酸乙酯的作用,二是起
的作用;
装置B部分除起导气作用外,还能起
的作用。为了提高装置B部分后一
作用的实验效率,请说出可采用的方法(任写出一种)。
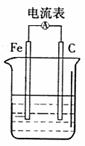 24.(11分)(1)如图所示,把一块铁片和一根碳棒插入到盛有0.01mol·L HCl的烧杯里,组成一个原电池,可观察到的主要现象为
24.(11分)(1)如图所示,把一块铁片和一根碳棒插入到盛有0.01mol·L HCl的烧杯里,组成一个原电池,可观察到的主要现象为
,其中铁片上的电极反应式为
;
碳棒上的电极反应式为
;铁片是 (填“正”或“负”)极。
(2)反应一段时间后,用pH试纸测定烧杯中溶液的pH,结果溶液的pH比反应前
(填“升高”、“降低”或“不变”),简述测定烧杯中溶液pH的操作步骤:
。
22. 对于可逆反应A(g)+3B(g) 2C(g),△H=
对于可逆反应A(g)+3B(g) 2C(g),△H=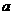 kJ/mol,平衡混合气体中C的体积分数与温度和压强的关系如图所示。下列判断正确的是
( )
kJ/mol,平衡混合气体中C的体积分数与温度和压强的关系如图所示。下列判断正确的是
( )
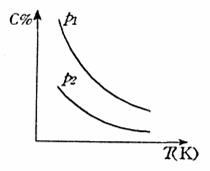 A.
A.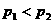 B.
B.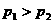 C.
C.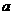 >0 D.
>0 D.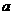 <0
<0
第Ⅱ卷(非选择题 共84分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com