
题目列表(包括答案和解析)
25.(8分)下列各物质转化关系如图所示,A是一种高熔点固体,D是一种红棕色固体。根据上述一系列转化关系回答:
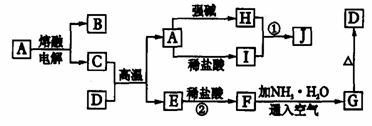

(1)填写物质的化学式:A ,D 。
(2)写出下列反应的离子方程式:
①H溶液和I溶液混合生成J 。
②F生成G 。
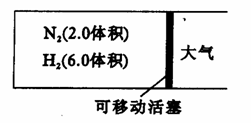
22 (10分)在一定温度下,把2.0体积N2和6.0体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,如下图。容器中发生的反应如下:
N2+3H2 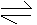
 2NH3+Q(Q>0)
2NH3+Q(Q>0)
若反应达到平衡后,测得混合气体为7.0体积。试回答:
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2、NH3的体积,如果反应达到平衡后,混合气体中各物质的体积分数仍与上述平衡完全相同。那么:
①若 a =1.0,c = 2.0,则 b = 。在此情况下,反应起始时将向 方向进行(填“正”或“逆”)。
②若规定起始时反应向逆方向进行,则c的范围是 。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是 ,原因是 。
23.(8分)已知反应AsO43-+2I-+2H+ 
 AsO33-+I2+H2O是可逆反应。现设计如图所示的实验装置,进行下述操作:①向B烧杯中逐滴加入浓盐酸,发现微安表指针偏转;②若改向B烧杯中滴加40%的NaOH溶液,发现微安表指针向前述相反方向偏转。试回答下列问题:(1) 两次操作过程中指针为什么会发生偏转?
AsO33-+I2+H2O是可逆反应。现设计如图所示的实验装置,进行下述操作:①向B烧杯中逐滴加入浓盐酸,发现微安表指针偏转;②若改向B烧杯中滴加40%的NaOH溶液,发现微安表指针向前述相反方向偏转。试回答下列问题:(1) 两次操作过程中指针为什么会发生偏转?
(2) 两次操作过程中指针偏转方向为什么相反?试用化学平衡移动原理解释之。
(3) ①操作过程中C1棒上发生的反应为 。
(4) ②操作过程中C2棒上发生的反应为 。


21.(12分) 要同时测定混有少量氯化钠杂质的芒硝(Na2SO4·nH2O)的纯度和结晶水的含量,按下列流程进行实验:

(1)加热脱水时,若有固体飞溅出来造成损失,则会使测得的结晶水的含量偏 。加热脱水后,若将样品露置于空气中冷却,则会使测得的结晶水的含量偏 。(填“高”或“低”)
(2)现有硝酸银、氯化钡、氯化钙、硝酸钡、氢氧化钡五种溶液,从测定的准确性考虑,可作为A溶液的分别是 。判断A溶液是否足量的方法是 。
(3)过滤时,应把滤纸上的沉淀洗涤干净,洗涤沉淀的方法是 。
(4)通过实验,测得芒硝化学式中的n值为10,则芒硝的纯度为 %
20.(3分)物质的量浓度相等的下列各物质的溶液中,NH4+. 浓度由大到小的顺序是
①(NH4)2CO3 ②(NH4)2SO4 ③ NH4HSO4
④(NH4)2 FeSO4 ⑤NH4Cl ⑥NH4HCO3
19.(6分).简答下面有关标准氢氧化钠溶液滴定待测盐酸的问题:
(1)盛放待测盐酸的锥形瓶下方垫一张白纸的作用是 。
(2)有下列错误操作:①碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准氢氧化钠溶液;②用酸式滴定管取用待测酸液前,尖嘴部分有气泡,取用过程中气泡消失;③滴定前,读碱液体积时视线低于碱式滴定管中的液面,滴定后读出碱液体积时,视线高于碱式滴定管中的液面;④锥形瓶用待测酸液润洗两次。
哪些错误操作会使盐酸浓度的测定值偏低?答: 。(填序号)
哪些错误操作会使盐酸浓度的测定值偏高?答: 。(填序号)
18. 在下列情况下, 离子组间一定能在溶液中同时大量共存的是:
A. 由水电离出的 [H+] = 10-14 mol/L 的溶液中: Na+、HCO3-、Cl-、SO42-
B. PH试纸呈现红色的溶液: Fe2+、K+、NO3-、Na+
C. CO32-可以大量共存的溶液: Ag+、K+、NO3-、Al3+
D. PH = 2 的溶液中: SO42-、K+、NO3-、Al3+
第二卷 非选择题(共78分)
17.某氨水的pH=x,某盐酸的pH=y,x+y=14,且x>11,将上述氨水和盐酸等体积混合后,所得溶液中各种离子浓度关系正确的是
A. [Cl-]>[NH4+]>[H+]>[OH-] B. [NH4+]>[Cl-]>[OH-]>[H+]
C. [Cl-]>[NH4+]>[OH-]>[H+] D. [NH4+]+[H+]=[OH-]+[Cl-]
16. 已知金属元素X的金属性Y的强,则下列说法正确的是
A. X肯定能从Y的盐溶液中置换出Y
B. X离子的氧化性一定比Y离子的弱
C. X单质的还原性比Y的强
D. 1molX单质失电子数一定比1molY失去的多
15.下列气体即不能用浓硫酸干燥,也不能用碱石灰干燥的是
A.NH3 B.SO3 C.HCl D.HBr
14.将2molPCl3和1molCl2充入一容积不变的密闭容器中,在一定条件下反应:
PCl3(g)+ Cl2 (g)
 PCl5(g),达到平衡时PCl5 为0.4mol。此时移走1molPCl3和0.5molCl2,在相同温度下达平衡时PCl5 的物质的量是
PCl5(g),达到平衡时PCl5 为0.4mol。此时移走1molPCl3和0.5molCl2,在相同温度下达平衡时PCl5 的物质的量是
A.0.4mol B 0.2mol C小于0.2mol
D.大于0.2mol而小于0.4mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com