
题目列表(包括答案和解析)
(五)问题和讨论
实验完成后,老师评议说:按上述实验设计,即使G中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与G之间加入一个装置。再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是__________,在B与G之间加入的装置可以是________________,其中盛放的药品是_______________。
(四)计算:样品中铜的质量分数=___________________(用含W、m1、m2 代数式表示)。
(三)实验内容:(无现象和无化学议程式的空格划调)
|
实验过程 |
实验现象 |
有关化学方程式 |
||
|
在G克加入样品标本W克,D中装入药品后并称量处m1克。连接好仪器后,检查气密性。 |
|
|
||
|
打开A的活塞,慢慢滴加溶液。 |
|
|
||
|
对G进行加热。当G中药品充分反应后。关闭A的活塞。停止加热。 |
|
|
||
|
冷却后,称量D的质量为m2克。 |
|
|
||
(二)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶等
药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰。浓硫酸等
(一)实验目的:____________________________________________
26、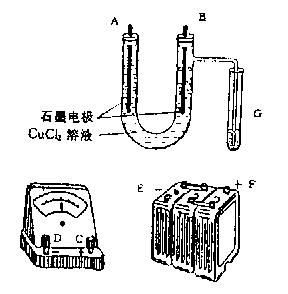 、某学生试图用电解法根据电极上析出的物质的量质量来验证阿佛加德罗常数值,其实验方案的要点为:①用直流电电解氯化铜溶液,所用仪器如右图:②在电流强度为I安培,通电时间为t秒后,精确测得某电极上析出的铜的质量为m克。试回答:
、某学生试图用电解法根据电极上析出的物质的量质量来验证阿佛加德罗常数值,其实验方案的要点为:①用直流电电解氯化铜溶液,所用仪器如右图:②在电流强度为I安培,通电时间为t秒后,精确测得某电极上析出的铜的质量为m克。试回答:
(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示。下同)E接_____,C接______,_______接F。实验线路中的电流方向为_____→_____→______→C→_____→______。
(2)写出B电极上发生反应的电极反应式_______________________G试管中淀粉KI溶液变化的现象为______________;相应的离子方程式是______________________________。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是_____________。(选填下列操作步骤的编号)①称量电解前电极质量②刮下电解后电极上的铜并清洗③用蒸馏水清洗电解后电极④低温烘干电极后称量⑤低温烘干刮下的铜后称量⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19库化。试列出阿佛加德罗常数的计算表达式:NA=__________________。
(5)电解质溶液有如下四种,哪一种可以用来做该实验,且误差最小( )
A、氯化铜溶液 B、AgNO3溶液 C、FeSO4溶液 D、Hg(NO3)2溶液
27、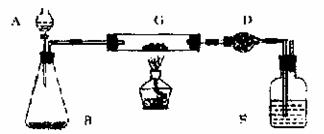 某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
25、一定温度下C(s)和水蒸气在密闭容器中发生反应,建立化学平衡:
 C(s)+H2O(g)
CO(g)+H2(g);△H>0。
C(s)+H2O(g)
CO(g)+H2(g);△H>0。
(1)平衡混合气的平均相对分子质量Mr(平)的取值范围为________>Mr(平)>__________。
(2)若使用CO和H2从逆反应方向在相同温度下建立平衡,则平衡混合气的平均相对分子质量Mr(平)的取值范围为___________>Mr(平)____________。此时若加压,平衡将_____________(向左、向右、不)移动,设原平衡时混合气中气体的物质的量共a mol,加压、重新达到平衡后气体比原来平衡减少b mol,则新平衡时混合气平均相对分子质量Mr’(平)和Mr(平)的关系为Mr’(平)=____________________(用Mr(平),a、b的数字表示。)
(3)在(2)建立的平衡中,①当Mr’(平)=Mr(平)时,Mr(平)=______________,此反应开始时,所用CO、H2的物质的量之比_____________________________。②当Mr(平)<_______________时,Mr’(平)<Mr(平),当Mr(平)>__________________时,Mr’(平)>Mr(平)。
(4)由(3)得出结论:从逆反应方向建立平衡时,Mr’(平)与Mr(平)的相对大小主要取决于__________________________________。
24、在相同物质的量浓度的KX、KY溶液中,分别通入适量的CO2发生反应KX+CO2+H2O=HX+KHCO3,2KY+CO2+H2O=2HY+K2CO3则相等物质的量浓度的KX、KY、KHCO3、K2CO3溶液的PH关系是___________________________。
23、工业上生产Na、Ca、Mg都用电解其熔融态的氯化物,但钾却不能用电解KCl的方法制得,因金属钾易溶于熔态的KCl中而有危险,难获得钾,且降低了电流效率。现生产钾是用金属纳吉深化的KCl反应制量。有关数据如下:
|
|
熔点(℃) |
沸点(℃) |
密度(g/m3) |
|
Na |
97.8 |
883 |
0.97 |
|
K |
63.7 |
774 |
0.86 |
|
NaCl |
801 |
1413 |
2.165 |
|
KCl |
770 |
1500 |
1.984 |
(1) 工业上制金属钾应该选择的温度范围__________℃~__________℃。
(2) 工业制金属钾主要应用了什么原使反应变为现实?_______________________。
22、司机酒后架车时可检测他呼出的气体,所利用的化学反应如下:
2CrO3(红色)+3C2H5OH+3H2SO4===Cr2(SO4)3(绿色)+3CH3CHO+6H2O
(1) 被检测的气体成分是________________________。
(2) 上述反应中的氧化剂是___________,还原剂是________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com