
题目列表(包括答案和解析)
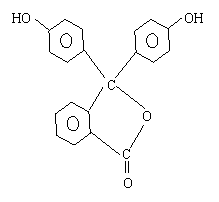
29、酚酞是常用的酸碱指示剂,其结构简式如图:
(1)酚酞的化学式为 。
(2)酚酞属于 、 类
衍生物。
(3)酚酞分别在1mol·L-1盐酸和1mol·L-1
NaOH溶液中溶解,在 中溶解度较大,原因
是 。
(4)烧碱溶液中加入几滴酚酞再加热可能的现象是 。
(5)在用标准盐酸滴定待测氢氧化钠的溶液中,若用酚酞作指示剂用量过多,对测定结果的影响是 。
28、A、B、C、D均为短周期元素。A、B可形成两种液态化合物,其最简式分别为BA和B2A,A与D可形成气态化合物DA、DA2,A、B、D可组成离子晶体,该晶体的化学式为B4A3D2,其水溶液呈弱酸性。B与D可形成一种极易溶于水的碱性气体X。B与C可形成极易溶于水的酸性气体Y。已知X分子与B2A分子中的电子数相等,Y分子与最简式为BA的分子中的电子数相等。请回答:
(1)写出四种元素的符号:A ,B ,C ,D
(2)写出下列反应的化学方程式:
①C2+(BA)n →A2 ②C2+X →D2
现有C2与X的混合气体1mol,充分反应后,测知被还原的元素的质量比被氧化的元素的质量多18.5g,则原混合物中X与C2的物质的量之比为 。
(3)B4A3D2的化学式为 ,其水溶液显酸性的离子方程式为 。
 (4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为
。
(4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为
。
27、将铝件与另一种材料作电极,以某种溶液作电解液进行电解,通电后在铝件与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝件表面形成一层较厚的氧化膜。某校研究性学习小组根据上述原理,以铝件和铁棒为电极,一定浓度的NaHCO3溶液为电解液进行实验。
(1)铝件表面形成氢氧化铝薄膜的电极反应式为:
(2)电解过程中,必须使电解液PH保持相对稳定(不能太大,也不能太小)的原因是
(3)使用NaHCO3溶液为电解液,会减缓阴极区溶液PH的增大,能说明这一原理的离子方程式为 。
|
质量已知),其反应方程式为:3CuO+2NH3 = 3Cu+N2↑+3H2O,下图为该实验的装置图,其中量N2体积的装置E是由甲、乙两根玻璃管组成的,它们用橡皮管连通,并装入适量水,甲管有刻度,供量气用,乙管可上下移动,以调节液面高度。
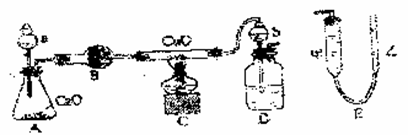
请回答以下问题:
(1)试剂a的名称为 ,锥形瓶内发生的化学反应方程式为 。
(2)装置D中b仪器的作用是 。
(3)实验开始时,在检验装置的气密性之后,必须首先 ,然后 ,再点燃C处酒精灯。
(4)反应前玻璃管和CuO总质量为m1g,反应结束后玻璃管和剩余固体质量为m2g,甲管量得气体体积为nL(标准状况),则氧的相对原子质量为 。
(5)为了较准确地测量N2体积,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意 (填字母)。
A、视线与凹液面最低处相平
B、等待片刻,待乙管中液面不再上升时,立刻读数
C、读数时应上下移动乙管,使甲、乙两管中液面相平
D、读数时要注意室内温度和气压
(6)下列操作可能造成测定结果偏高的是 (填字母)。
A、加热前未排尽系统内的空气 B、玻璃管内的CuO有剩余
C、将D处浓H2SO4换成水 D、读甲管终点视数时,俯视甲管内液面
25、某二价金属碳酸盐和酸式碳酸盐的混合物跟足量的盐酸反应,消耗H+和产生的CO2的物质的量之比为6 :5,该混合物中碳酸盐和酸式碳酸盐的物质的量之比为
A、1 :1 B、1 :2 C、1 :3 D、1 :4
24、 工业上用以合成氨的原料之一 --氢气,有一种来源是取自石油气。例如丙
工业上用以合成氨的原料之一 --氢气,有一种来源是取自石油气。例如丙
烷,有人设计了以下反应途径:(1)C3H8 3C+4H2 ; (2)C3H8 C3H6
+H2 ;(3)C3H8+3H2O 3CO+7H2 ;(4)C3H8+5O2 → 3CO2+4H2O ,
2H2O 2H2↑+O2↑。假设反应都能进行,请你判断出最合理的途径,利用该途径,理论上用1mol丙烷最多可制得氨
A、4mol B、6.7mol C、10mol D、2.7mol
23、14gCu、Ag合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况)O2混合,恰好被水全部吸收生成硝酸,则金属中Cu的质量为
A、1.6g B、3.2g C、6.4g D、9.6g
22、加热25gA,5gB,10gC的混合物,使之充分反应,所得混合物中含有10gA,21gC,还有另一种物质D,假设A、B、C、D代表反应物或生成物的化学式,并令它们的式量依次是30,20,44,18,则反应的化学方程式是
A、2A+B=C+2D B、A+2B=2C+D C、2A+B=2C+D D、A+2B=C+2D
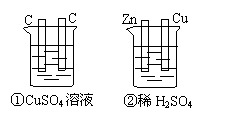
21、如图所示的两个装置中,溶液的体积均为
200mL,开始时电解质溶液的浓度均为0.1mol/L,工
作一段时间后,测得导线上通过0.02mol电子,若不
考虑盐的水解和溶液的体积变化,则下列叙述正确的是
A、产生气体的体积(1)>(2)
B、电极上析出固体物质的质量(1)>(2)
C、溶液PH变化(1)增大,(2)减小
D、电极反应式:(1)中阳极:4OH--4e- = 2H2O+O2↑
(2)中负极:2H++2e-=H2↑
20、R2O8n-在一定条件下可以把Mn2+氧化成MnO4-,自己则完全转变成RO42-,又知该反应中氧化剂还原剂的物质的量之比为5 :2,则n 值为
 A、1 B、2 C、3 D、4
A、1 B、2 C、3 D、4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com