
题目列表(包括答案和解析)
3.下列叙述中,正确的是
A.表中第①组反应的氧化产物只有FeCl3(实为Fe3+)
B.氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+
C.还原性比较:H2O2>Mn2+>Cl-
D.④的离子方程式配平后,H+的化学计量数应为16
2.若对应于上述离子方程式的电子转移总数为10,则反应物、生成物的组序号是
A.②和④ B.只有② C.只有④ D.只有③
1.下列说法正确的是
A.水分子是由两个氢元素和一个氧元素组成
B.在化合物中,元素的化合价的数值就是原子得失电子的数目,失去电子为正价,获得电子为负价
C.一个过氧化氢分子中含有两个氢原子和两个氧原子
D.能电离出H+和酸根离子的物质一定是酸
根据下表提供的材料,回答2、3题。
|
序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
|
① |
Cl2 |
FeBr2 |
|
|
FeCl3 |
|
② |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
MnSO4 |
|
③ |
KClO3 |
HCl(浓) |
|
Cl2 |
Cl2 |
|
④ |
KMnO4 |
HCl(浓) |
|
Cl2 |
MnCl2 |
33、在4000C,101.3k Pa时,3L某烃A在mL氧气中完全燃烧,燃烧后测得气体体积(m+6)L(气体体积均在同温同压下测定)试回答下列问题:
(1)通过计算说明,烃A的组成中应满足的条件。
(2)通过计算推断,当m=27时,烃A可能的分子式(只要求写出三种可能的分子式)。
三种可能的分子式是: , , 。
(3)通过计算确定,若烃A在常温常压下为气态物质时,m的取值范围。
32、现有100mL,1mol/L的纯碱溶液和100mL 1.25mol/L的盐酸,
(1)若将上述纯碱溶液逐滴加入到盐酸溶液中,忽略CO2溶解的量,求收集到CO2的体积(标准状况);
(2)若将上述盐酸逐滴加入到纯碱溶液中,反应完全后,CO2在溶液中的浓度为0.04mol/L,假定溶液的体积不变,求收集到的CO2的体积和生成物NaCl的物质的量浓度。
31、为扩大现有资源的使用效率,在一些油品中加入降凝剂J,以降低其凝固点,扩大燃料油品的使用范围。J是一种高分子聚合物,它的合成路线可以设计如下,其中A的氧化产物不发生银镜反应:
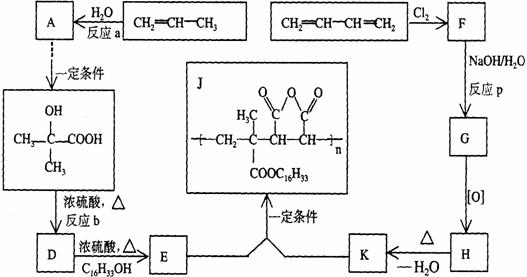
试写出:
(1)反应类型:a_________、b__ __p____ _;
(2)结构简式:F_________、H____________;
(3)化学方程式:D→E_________,E+K→J__________。
30、(7分)有机物A和B无论以何种比例混合,其组成的混合物中所含原子的核外电子总数均不变。
(1)若A是分子中含8个氢原子的烃,B是分子中含3个碳原子的烃的含氧衍生物。写出两组符合上述要求的有机物的分子式。
①相对分子质量之差为2:A B
②相对分子质量相等:A B
(2)若A是分子中含有4个碳原子的烃,B是饱和链烃的一元含氮衍生物。则A分子式为 ,B的分子式为 ,符合B分子式的同分异构体有 种。
29、酚酞是常用的酸碱指示剂,其结构简式如图:
(1)酚酞的化学式为 。
(2)酚酞属于 、 类
衍生物。
(3)酚酞分别在1mol·L-1盐酸和1mol·L-1
NaOH溶液中溶解,在 中溶解度较大,原因
是 。
(4)烧碱溶液中加入几滴酚酞再加热可能的现象是 。
(5)在用标准盐酸滴定待测氢氧化钠的溶液中,若用酚酞作指示剂用量过多,对测定结果的影响是 。
28、A、B、C、D均为短周期元素。A、B可形成两种液态化合物,其最简式分别为BA和B2A,A与D可形成气态化合物DA、DA2,A、B、D可组成离子晶体,该晶体的化学式为B4A3D2,其水溶液呈弱酸性。B与D可形成一种极易溶于水的碱性气体X。B与C可形成极易溶于水的酸性气体Y。已知X分子与B2A分子中的电子数相等,Y分子与最简式为BA的分子中的电子数相等。请回答:
(1)写出四种元素的符号:A ,B ,C ,D
(2)写出下列反应的化学方程式:
①C2+(BA)n →A2 ②C2+X →D2
现有C2与X的混合气体1mol,充分反应后,测知被还原的元素的质量比被氧化的元素的质量多18.5g,则原混合物中X与C2的物质的量之比为 。
(3)B4A3D2的化学式为 ,其水溶液显酸性的离子方程式为 。
 (4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为
。
(4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为
。
27、将铝件与另一种材料作电极,以某种溶液作电解液进行电解,通电后在铝件与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝件表面形成一层较厚的氧化膜。某校研究性学习小组根据上述原理,以铝件和铁棒为电极,一定浓度的NaHCO3溶液为电解液进行实验。
(1)铝件表面形成氢氧化铝薄膜的电极反应式为:
(2)电解过程中,必须使电解液PH保持相对稳定(不能太大,也不能太小)的原因是
(3)使用NaHCO3溶液为电解液,会减缓阴极区溶液PH的增大,能说明这一原理的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com