
题目列表(包括答案和解析)
33.50.0g20.0%的NaOH溶液和0.500mol·L-1的HCl溶液(密度为1.10g·cm-3)550g恰好完全中和生成密度为1.15g·cm-3的NaCl溶液。计算:
(1)NaCl溶液的质量分数。
(2)NaCl溶液物质的量浓度。
32.由Fe2O3、CuO组成的混合物32g溶于200mL稀硫酸溶液中,然后加入4mol·L-1NaOH溶液,开始无沉淀生成,随着NaOH溶液的加入,沉淀量增多,当加入300mLNaOH溶液时恰好沉淀完全,求原稀硫酸溶液的物质的量浓度是多少?
31.在常温常压下100mLH2S和O2的混合气体,在点燃条件下充分反应(O2完全反应),恢复到原状态时剩余25mL气体,求原混合气体中H2S和O2各为多少毫升?
30.在已经提取了NaCl、MgBr2等化学物质的富碘卤水中,采用如下工艺流程生产碘单质:
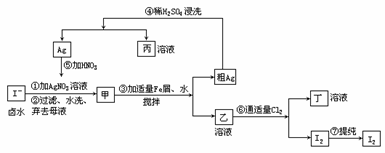
(1)乙、丁中溶质的分子式:乙______,丁______。
(2)第④步操作中用稀H2SO4浸洗的目的是______(填编号)。
A.除去未反应的NO3-B.除去未反应的I-C.除去未反应的FeD.除去碱性物质
(3)第①步操作可供提纯I2的两种方法是______。
(4)甲物质见光易变黑,其原因是(用化学方程式表示):_______。
(5)反应⑤中所加的HNO3应选(填“稀、浓”)______硝酸,原因是______。
29.在一烧杯中盛有100mL、2mol·L-1的H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如图8-4所示)。向该烧杯里缓缓注入0.4mol.L-1的Ba(OH)2溶液至恰好完全反应,在此实验过程中
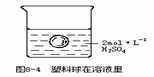
(1) 烧杯里观察到的实验现象有:①______;②______。
(2)写出实验过程中反应的离子方程式______。
28.海藻中含有丰富的碘元素(以Ⅰ-形式存在)。实验室中提取碘的流程
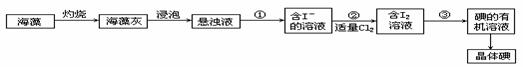
(1)在虚线框内画出实验操作①的仪器装置示意图。实验操作③的名称是______,所用主要仪器名称为______。
(2)提取碘的过程中,可供选择的有机试剂是______(填序号,多选扣分)。
A.酒精(沸点78℃)B.四氯化碳(沸点77℃)C.氯化钠溶液D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消除此杂质,使碘全部游离出来,应加入适量(填序号)______溶液,反应的离子方程式为______。
A.KIO3B.HClOC.KID.Br2
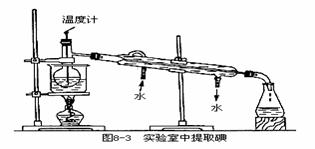
(4)为使从含碘有机溶液中提取碘并回收溶剂顺利进行,采用水浴加热蒸馏(如图8-3所示)。请指出图中实验装置中错误之处(有几处填几处,下列空白可不填满,也可补充)。①______②③④_______
(5)实验中使用水浴加热的原因是______,最后晶体碘聚集在______(填仪器名称)中。
27.已知实验室可通过下列反应制取硫化氢(实验室制备H2S装置与制CO2相似)气体:FeS+H2SO4(稀)=FeSO4+H2S↑。为验证二氧化硫既有还原性又有氧化性,请用下面的试剂和图8-2的仪器进行实验。可选用试剂有:①盐酸,②溴水,③亚硫酸钠固体,④硫化亚铁固体,⑤品红试液,⑥氢氧化钠溶液,⑦浓硫酸。可选用的仪器装置如图所示:(1)按二氧化硫气流方向,用橡皮管(图中未画出)连接上述仪器,正确的连接顺序是(用导管口序号填空):______接______,______接______(或______)。
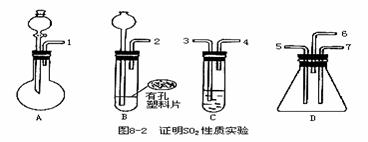
(2)在装置A、B、C中应加入试剂是(用试剂名称填空):A______,B______,C______。
(3)表现二氧化硫氧化性实验所用的是上述装置中的______,实验中观察到的现象是______;表现二氧化硫的还原性实验所用的是上述装置中的______,实验中观察到的现象是______,其反应的离子方程式是______。
(4)整套装置最后气体出口导管应连接______装置,这样处理的原因是______。
26.将40℃的饱和石灰水冷却至10℃,或加入少量CaO,但温度仍保持40℃,这两种情况下均不改的是______。
A.Ca(OH)2的溶解度B.溶液中溶质的质量分数C.溶液的质量D.溶液中Ca2+的数目
25.将m1g锌加到m2g20%的盐酸中去,反应结果共放出nL氢气(标准状态),则被还原的HCl的物质的量是______。
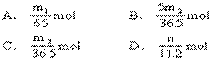
24.质量分数相等的Na2CO3和NaHCO3的混合物ag,加热一段时间后质量变为bg。当NaHCO3完全分解时b值是_______。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com