
题目列表(包括答案和解析)
30.下面是四种盐在不同温度下的溶解度(g/100gH2O)

(假设:①盐类共存时不影响各自的溶解度。②分离晶体时,溶剂的损耗忽略不计。)
某同学设计用物质的量比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如图:
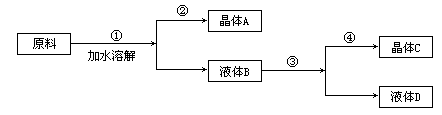
(1)在①和③的实验过程中,关键的实验条件是_______。
(2)分离出晶体的②和④的操作是______(填“倾倒”、“蒸发”、“结晶”、“过滤”中的某种操作)。硝酸钾是晶体_______(A或C)
(3)粗产品中可能含有的杂质离子是______;检验的方法是______。
(4)欲将粗产品提纯,可采取的方法是______。
29.将以下各项内容中浓H2SO4所起的作用或表现出的性质及有关化学方程式填写在空格里。
(1)浓H2SO4与木炭加热反应,表现的性质是______,有关化学方程式为______。
(2)浓H2SO4敞口放置在空气中,质量增加,表现的性质是______。
28.在标准状况下有①6.72LCH4;②3.01×1023个HCl分子;③13.6g硫化氢;④0.2mol氨气,将下列各项用序号标出从大到小的顺序。
(1)体积______;(2)密度_______;
(3)质量______;(4)含氢原子个数______。
27.有一包白色粉末,其中含有氯化钠、碘化钾、碳酸钠、无水硫酸铜、氯化钡中的一种或几种,取粉末试样,进行下述实验。
(1)溶于蒸馏水得到无色溶液和白色沉淀。
(2)在溶液中滴入硝酸银溶液,又产生夹带白色的黄色沉淀
(3)在(2)沉淀中滴入稀硝酸,沉淀部分溶解并产生无色无臭气体。由此推断,粉末中一定含有的物质是______;一定不存在的物质是______;可能存在的物质是_______。
26.A元素原子有3个电子层,最外层上有6个电子,B元素原子比A元素原子少5个电子。
(1)B元素的原子结构示意图是______。
(2)A、B两元素形成的化合物的化学式是______。
(3)A元素形成的氢化物常温下与它的一种气态氧化物发生反应的化学方程式是______,当有1.5mol氧化物参加反应时,共______个电子发生转移,该反应氧化产物与还原产物的质量比是______。
25.氰气的化学式为(CN)2其化学性质与卤素相似,下列叙述中正确的是
A.1mol氰气含有2mol原子
B.氰气能跟水发生反应
C.氰化钠和氰化银都不溶于水
D.(CN)2可与氢氧化钾溶液反应
24.在等物质的量的短周期金属元素单质A和B中,分别加入足量的酸,在A中加入盐酸,在B中加入稀硫酸,反应完全后,生成氢气的体积分别为X(A)和Y(B),而且X(A)≠Y(B),若要确定反应生成物中A和B的化合价,至少还需要知道的数据是______。
A.X(A)∶Y(B)的值
B.X(A)[或Y(B)]的值
C.A(或B)的物质的量
D.HCl和H2SO4的物质的量浓度
23.在3BrF3+5H2O=HBrO3+Br2+9HF+O2的反应中,氧化产物与还原产物的物质的量之比为______。
A.1∶2
B.2∶1
C.3∶5
D.5∶3
22.重水A和普通水B分别跟足量的金属钠反应,下列叙述正确的是
A.A、B质量相等时,产生气体的体积在同温同压下相等
B.A、B质量相等时,产生气体的质量相等
C.A、B的物质的量相等时,产生气体的体积在同温同压下相等
D.A、B的物质的量相等时,产生气体的质量相等
21.下列反应的离子方程式错误的是______。
A.碳酸钙与盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
B.将SO2气体通入溴水中:SO2+Br2+2H2O=2HBr+SO42-+2H+
C.在漂白粉水溶液中通入SO2气体:
Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D.碳酸氢钠溶液与NaOH溶液反应:HCO3-+OH-=CO32-+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com