
题目列表(包括答案和解析)
17、工业制纯碱时,第一步是通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶,它的反应原理可以用下面的方程式表示:NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl
以上反应的总结果是放热反应。请设计一个实验:用最简单的实验装置模拟实现这一过程,获得碳酸氢钠结晶。可供选择的实验用品有:6 mol·L-1盐酸,6mol·L-1硫酸,浓氨水,氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。
⑴画出实验装置示意图(包括反应时容器中的物质),并用图中玻璃容器旁自基至右分别用A、B、C……符号标明(请见题后说明)
⑵请写出在图上用A、B、C……各玻璃容器中盛放物质的化学式或名称。A:
B: C: D: E:
⑶利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶。 答:
说明:①本题装置示意图中的仪器可以用下面的方式表示。


敞口玻璃容器 有塞玻璃容器 玻璃漏斗 分液漏斗

 玻璃导管
(但应标示出在液面上或液面下)
玻璃导管
(但应标示出在液面上或液面下)
②铁架台、石棉网、酒精灯、玻璃导管之间的联接胶管等,在示意图中不必画出。如需加热,在需加热的仪器下方,标以“△”表示。
36.(12分)1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体(如图),该结构的建立基于以下的考虑:
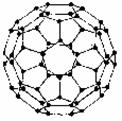
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键
②C60分子只含有五边形和六边形
③多面体的顶点数、面数和棱这数的关系,遵循欧拉定理:
顶点数 + 面数-棱边数 = 2
据上所述,可推知C60分子有12个五边形和20个六边形, C60分子所含的双键数为30。
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是[答:金刚石],理由是[答:金刚石的晶体类型是原子晶体,而固体C60不属于原子晶体(实际上可以认为是分子晶体)]
(2)试估计C60跟F2在一定条件下能否发生反应生成C60F 60(填“可能”或“不可能”)[答:可能],并简述其理由[答:因C60分子中含有30个双键,与极活泼的F2发生加成反应可能生成C60F60]
(3)通过计算,确定C60分子所含单键数。
[解]:由欧拉定理计算键数为60+(12+20)-2=90,则分子中的单键数=90-30=60
(4) C70分子也已经制得,它的分子结构模型可以与C60同样考虑面推知。通过计算确定C70分子中五边形和六边形的数目。
[解]:设C70分子中的五边形的数目为x个,六边形的数目为y个,由题意可得方程组:
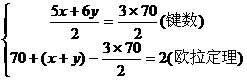 解得五边形的数目x=12,六边形的数目y=25
解得五边形的数目x=12,六边形的数目y=25
35.(6分)将8.8克FeS固体置于200毫升2.0摩/升的盐酸中,以制备H2S气体。反应完全后,若溶液中H2S的浓度为0.10摩/升,假定溶液体积不变,试计算: (1)收集到的H2S气体的体积(标准状况)。 (2)溶液中Fe2+和H+的物质量浓度(摩尔浓度)
[提示]:根据方程式FeS+2H+
= Fe2++H2S可判断盐酸过量,计算以FeS的物质的量为基准。FeS的物质的量=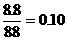 摩尔
(1)共生成H2S0.10摩尔,在溶液中溶解的物质的量为0.10×0.20=0.02摩尔,所以收集到H2S气体的物质的量=0.10-0.02=0.08摩尔,换算成体积=22.4×0.08=1.8升。
(2)生成Fe2+0.10摩尔,其浓度为
摩尔
(1)共生成H2S0.10摩尔,在溶液中溶解的物质的量为0.10×0.20=0.02摩尔,所以收集到H2S气体的物质的量=0.10-0.02=0.08摩尔,换算成体积=22.4×0.08=1.8升。
(2)生成Fe2+0.10摩尔,其浓度为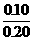 =0.5摩/升,消耗掉H+的物质的量为0.20摩尔。反应前H+的物质的量为2.0×0.2=0.4摩尔,故H+最后的浓度为
=0.5摩/升,消耗掉H+的物质的量为0.20摩尔。反应前H+的物质的量为2.0×0.2=0.4摩尔,故H+最后的浓度为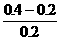 =1.0摩/升。
=1.0摩/升。
34.(7分)A、B都是芳香族化合物,1摩尔A水解得到1摩尔B和1摩尔醋酸。A、B的分子量都不超过200,完全燃烧都只生成CO2和H2O,且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652)。A的溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B的分子量之差为[答:42]
(2)1个B分子中应该有[答:3]个氧原子
(3)A的分子式是[答:C9H8O4]
(4)B可能的三种结构简式是
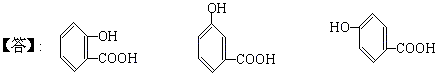 [提示]:A+H2O
® CH3COOH+B,设MA、MB分别为A、B的分子量,MA+18=60+MB,MA-MB=42,所以A、B分子量之差为42,B分子量不超过200-42=158,A显酸性,不能使FeCl3溶液显色,说明有羧基,因此B也有羧基,且有从A(醋酸酯)水解产生的羟基,推测B可能有3个氧原子。由题意B可能的分子量MB=
[提示]:A+H2O
® CH3COOH+B,设MA、MB分别为A、B的分子量,MA+18=60+MB,MA-MB=42,所以A、B分子量之差为42,B分子量不超过200-42=158,A显酸性,不能使FeCl3溶液显色,说明有羧基,因此B也有羧基,且有从A(醋酸酯)水解产生的羟基,推测B可能有3个氧原子。由题意B可能的分子量MB=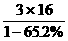 =138<158合理,由分子量为138且含有羧基和羟基,推得B为羟基苯甲酸。
=138<158合理,由分子量为138且含有羧基和羟基,推得B为羟基苯甲酸。
33.(6分)通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构:
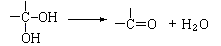 下面是9个化合物的转变关系:
下面是9个化合物的转变关系:
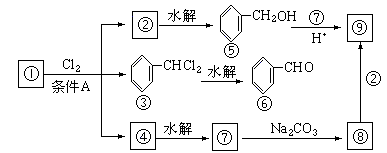 (1)化合物①是[答:甲苯],它跟氯气发生反应的条件A是[答:光照]
(2)化合物⑤跟⑦可在酸的催化下去水生成化合物⑨, ⑨的结构简式是:[答:略]名称是[答:苯甲酸苯甲酯(或苯甲酸苄酯)]
(3)化合物⑨是重要的定香剂,香料工业上常用化合物⑧和②直接合成它。此反应的化学方程式是
(1)化合物①是[答:甲苯],它跟氯气发生反应的条件A是[答:光照]
(2)化合物⑤跟⑦可在酸的催化下去水生成化合物⑨, ⑨的结构简式是:[答:略]名称是[答:苯甲酸苯甲酯(或苯甲酸苄酯)]
(3)化合物⑨是重要的定香剂,香料工业上常用化合物⑧和②直接合成它。此反应的化学方程式是
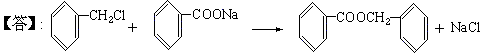
32.(4分)有机化学中取代反应的范畴很广。下列6个反应中,属于取代反应范畴的是(填写相应的字母):[答:A、C、E、F]
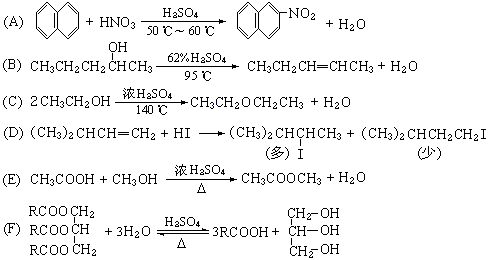
(式中R是正十七烷基CH3(CH2)15CH2-)
31.(7分)某无色溶液可能含有下列钠盐中的几种:(A)氯化钠(B)硫化钠(C)亚硫酸钠(D)硫代硫酸钠(E)硫酸钠(F)碳酸钠。向此溶液中加入适量稀硫酸,有浅黄色沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。根据上述实验现象回答下列问题:
(1)不能使品红试液褪色,说明该气体中不含[答:SO2](填分子式)。
(2)此无色溶液至少存在哪几种盐?请写出全部可能的情况(填写相应的字母):
第一种情况是:[答:B、C、F]
第二种情况是:[答:B、D、F]
第三种情况是:
第四种情况是:
30.(5分)试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按下图进行实验:
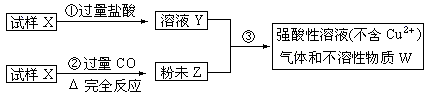
(1)请写出步聚③中发生的全部反应的离子方程式: [答:Cu2++Fe == Cu+Fe2+ 2H++Fe == H2+Fe2+]
(2)若全部的溶液Y和全部的粉未Z充分反应,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为(用m表示):
[答:0.625m(或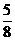 m)]
m)]
29.(5分)(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:[答:2HSO4-+Ba2++2OH- == 2H2O+BaSO4¯+SO42-或2H++SO42-+Ba2++2OH- == 2H2O+BaSO4¯] (2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:
[答: SO42-+Ba2+ == H2O+BaSO4¯]
28.(10分)1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水)。
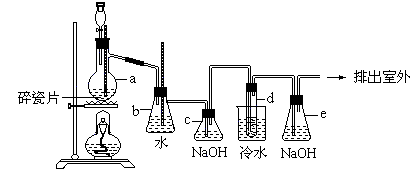
填写下列空白: (1)写出本题中制备1,2-二溴乙烷的两个化学方程式
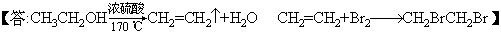 (2)安全瓶b可以以上倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象。
[答:b中水面会下降,玻璃管中的水面会上升,甚至溢出]
(3)容器c中NaOH溶液的作用是:
[答:除去乙烯中带出的酸性气体或答二氧化碳、二氧化硫]
(4)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因。
[答:①乙烯发生(或通过液溴)速度过快 ②实验过程中,乙烯和浓硫酸的混合液没有迅速达到170℃(或写“控温不当”也可以)]
(2)安全瓶b可以以上倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象。
[答:b中水面会下降,玻璃管中的水面会上升,甚至溢出]
(3)容器c中NaOH溶液的作用是:
[答:除去乙烯中带出的酸性气体或答二氧化碳、二氧化硫]
(4)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因。
[答:①乙烯发生(或通过液溴)速度过快 ②实验过程中,乙烯和浓硫酸的混合液没有迅速达到170℃(或写“控温不当”也可以)]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com