
题目列表(包括答案和解析)
1.100ml 6mol/L H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可问反应物中加入适量的( )
A.Na2SO4(s) B.H2O C.K2SO4溶液 D.(NH4)2SO4(s)
知识点:本题考查浓度对反应速率的影响
能力点:培养学生正确理解和应用能力
10.合成氨的简要流程
原料气的制备 净化
净化 压缩
压缩 合成
合成 分离
分离 液氨
液氨
9.合成氨适宜条件的选择。
①选择原则:能加快反应速率;提高原料的利用率;提高单位时间的产量;对设备条件要求不能太高。
②合成氨的适宜条件:使用催化剂;500℃;2×107-5×107Pa。
8.原料气的制备:
①空气中取氮:分离液态空气或用炽热的炭处理空气后再净化。
②水中取氢:水和焦炭反应。
7.合成氨的反应原理:N2(g)+3H2(g) 2NH3(g)+92.4KJ
2NH3(g)+92.4KJ
合成氨是一个气体体积缩小的放热可逆反应。
6.外界条件对化学平衡的影响。
(1)浓度:其它条件不变时,增大反应物浓度或减小生成物浓度都会使平衡向正反应方向移 动。
改变物质浓度不包括固体和纯液体,即固体或纯液体物质的量的增加和减少,不影响浓度, 从而不影响化学反应速率,也不影响化学平衡。
(2)压强:其它条件不变时,增大压强,会使平衡向气体体积缩小的方向移动。
注意:
①若反应前后气体体积无变化,改变压强,能同时改变正、逆反应速率,V正=V逆,平衡不移动。
②压强变化是指平衡混合物体积变化而引起的总压变化,若平衡混合物的体积不变,而加入 “惰气”,虽然总压变化了,但平衡混合物的浓度仍不变,速率不变,平衡不移动。
③若加入“惰气”,保持总压不变,此时只有增大体系体积,这就相当于降低了平衡体系的 压强,平衡向气体体积增大的方向移动。
(3)温度:在其它条件不变时,升高温度,化学平衡向吸热反应方向移动。降低温度,平衡 向放热反应方向移动。
(4)催化剂:催化剂能同等程度地改变正、逆反应速率,因此不影响化学平衡,但可大大地 缩短反应达到平衡所需的时间。
(5)勒沙特列原理:如果改变影响平衡的一个条件,平衡就向能够减弱这种改变的方向移动 。注意:勒沙特列原理的适用范围是:化学平衡,电离平衡,溶解平衡,水解平衡,状态平衡等。
5.可逆反应进行程度的描述方法--转化率、产率。
(1)反应物的转化率=反应物的转化量/该反应物起始量×100%
(2)产物的产率=产物的实际量/该产物的理论量×100%
4.化学平衡移动
(1)当外界条件改变时,可逆反应从一种平衡状态向另一种平衡状态转化的过程。
(2)平衡发生移动的根本原因:V正、V逆发生改变,导致V正≠V逆。
(3)平衡发生移动的标志:新平衡与原平衡各物质的百分含量发生了变化。
注意:
①新平衡时:V′正≠V′逆,但与原平衡速率不等。
②新平衡时:各成分的百分含量不变,但与原平衡不同
③通过比较速率,可判断平衡移动方向
当V正>V逆时,平衡向正反应方向移动
当V正<V逆时,平衡向逆反应方向移动
当V正=V逆时,平衡不发生移动
2.影响化学反应速率的因素。
决定化学反应速率的主要因素是反应物的结构,性质,反应历程。除此之外,外部条件,为反应物的浓度、压强、温度、催化剂以及固体反应物表面积的大小、溶剂、光、电磁波、激光、超声波等都会影响化学反应的速率。
(1)浓度:在其它条件不变时,增大反应物浓度,化学反应速率加快;反之则反。
注意:固体,纯液体的浓度均可视作常数。因固体物质间的反应只与接触面积有关,故固体物质的量的改变对反应速率无影响。
(2)压强:在其它条件不变时,增大气体反应体系压强,化学反应速率加快;反之则反。
注意:改变压强,对化学反应速率产生影响的根本原因是引起浓度改变。所以,在讨论压强对反应速率的影响时,应区分引起压强改变的原因。
对于气体反应体系,有以下几种情况:
①恒温时:增加压强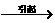 体积缩小
体积缩小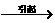 浓度增大
浓度增大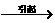 应速率加快。
应速率加快。
②恒容时:
a.充入气体反应物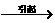 浓度增大
浓度增大 总压增大
总压增大 反应速率加快。
反应速率加快。
b.充入“惰气”  总压增大,但各物质浓度不变,反应速率不变。
总压增大,但各物质浓度不变,反应速率不变。
③恒压时:充入“惰气”  体积增大
体积增大 各反应物浓度减少
各反应物浓度减少 反应速率减慢。
反应速率减慢。
(3)温度:其它条件不变时,升高温度,反应速率加快。
温度每升高10℃,化学反应速率增大到原来的2-4倍。升高反应体系的温度,是提高反应速率的有效途径。
(4)催化剂:使用正催化剂,能加快化学反应速率。反之则反,未特殊指明时,均指正催化剂。3.化学平衡状态
(1)概念:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的质量分数保持不变的状态。
(1) 特征
①逆:研究对象可逆反应。
②等:V(正)=V(逆)≠O
③动:化学平衡是动态平衡。虽然V(正)=V(逆),但正、逆反应仍在进行,其反应速率不等于零。
④定:各组分的质量分数一定。
⑤变:外界条件改变,平衡也随之改变。
⑥无:化学平衡的建立与反应从哪个方向(正向、逆向、双向)开始无关。
1.化学反应速率的表示方法及特点。
(1)表示方法:
用单位时间内反应物浓度的减少或者生成物浓度的增加来表示。
表达式: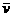 =
=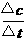
单位:由浓度的单位和时间的单位决定。mol/L·h、mol/L、min、mol/L·S等。
(2)特点:
①化学反应速率是平均速率,且均取正值。
②同一反应选用不同物质浓度的改变量表示速率,数值可能不同,但表示的意义相同。
③各物质表示的速率比等于该反应方程式的系数比。
例:对于反应:mA+nB pC+qD
pC+qD
VA∶VB∶VC∶VD=m∶n∶p∶q
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com