
题目列表(包括答案和解析)
研究对象:可逆反应的反应规律,即可逆反应进行到什么程度的基本理论。
1、可逆反应:相同条件既能向正反应方向进行,同时又能向逆反应方向进行的反应,
即不可能完全进行的反应,多数化学反应为可逆反应,差别是正、逆反应进行的程度不相同。即使进行得较完全的中和反应亦为可逆(盐类水解)。
2、影响化学反应速率的条件
(1)主要(决定性)因素--反应物本身的性质。但同一反应,不同条件,反应速率不相同。
(2)外界条件①浓度:其它条件不变,增大反应物浓度v加快。
例如:硫在纯氧中燃烧比在空气中燃烧更剧烈等。
注意:浓度一般指气体或溶液,纯液体或固体浓度是一定值,量的增减一般不影响反应速率。对可逆反应,浓度改变可以是反应物或生成物或同时改变,但均符合“浓快稀慢”的规律。
②压强:对有气体参加的反应,温度不变,增大压强,v加快,减小压强, v减慢。
注意:①压强改变针对气体而言,固体或液体,压强对其没有影响。
②针对可逆反应,压强对v正、v逆影响相同,但影响程度不一定相同。
③压强的改变,本质上是改变气体的浓度,因此,压强改变,关键看气体浓度有没有改变,v才可能改变。
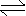 例:反应C(s)+H2O(g) CO(g)+H2(g)在可变容积的密闭容器中进行,下列的改变,对化学反应速率的影响如何?
例:反应C(s)+H2O(g) CO(g)+H2(g)在可变容积的密闭容器中进行,下列的改变,对化学反应速率的影响如何?
A、增加碳的量 B、容器的体积缩小一半 C、保持体积不变,充入N2,使体系的压强增大一倍 D、保持压强不变充入N2。
解析:增加碳的量,不影响反应速率,因为固体浓度是一定值。容器体积缩小一半(即增大压强),气体浓度变大v加快。当充入N2,由于容器体积不变,尽管压强增大,但气体的浓度并未改变。因此v不变。而充入N2,保持压强不变。容器的体积一定要扩大,此时气体浓度一定减小,v一定要减小。
(3)温度:其它条件不变,温度越高,v越大,温度越低, v减小。
温度对化学反应速率的影响较大,每升高100C,v增大至原来的2~4倍,因此,在实际生产中,绝大多数是在高温下进行。
思考:①温度每升高100C,反应速率增大为原来的a倍,现升高了500C现反应速率是原来的多少倍?(a5倍)
②反应M+N→P,每升高100C,反应速率增加3倍,在100C时完成反应的10%需81分钟,现将温度提高到300C,完成反应的10%,需要几分钟(9分钟)
注意:①温度对v影响与物质聚集状无明显关系
②可逆反应,不管放热还是吸热反应,正、逆反应速率均要加快但影响程度不同。
例:使Zn与10%的稀硫酸反应速率比Zn与12%H2SO4反应速率大,最适宜的方法是什么?(加热)
(4)催化剂--改变化学反应速率,通常有正、负之分。使用催化剂的反应较多,有些反应实用性只有在使用催化剂才能体现出来,特别是石油化工生产。
注意:①催化剂不能使本身不发生反应的反应发生。
②工业生产中要防止催化剂中毒
③催化剂对正逆反应的速率影响是相同的
(5)其它因素:如光、颗粒大小、溶剂等。
1、概念:所谓化学反应速率即表示一个化学反应进行的快与慢(不仅仅局限可逆反应、
适用所有的化学反应),最初就是用快(象H2、O2爆炸)慢(铁生锈),这快、慢是定性描述。如何定量表示化学反应速率?
单位时间内反应物浓度的减小或生成物浓度的增加来表示。其数学表达式为:v=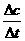
注意:①v是平均速率还是瞬时速率?(平均,因为开始时浓度大、速率大)
②当反应物是固体时能否定量表示反应速率?(能,虽然固体不能讲浓度,但用单位时间物质的量减小或增大来表示)
③同一反应用不同物质表示反应速率数值是否一定相同?(不一定,但表示的意义完全相同)。同一反应中,各物质的速率之比一定等于其计量系数之比。
18.Fe3+和I-在水溶液中的反应如下:2I +2Fe
+2Fe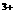
 2Fe
2Fe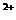 +I2(水溶液)。
+I2(水溶液)。
(1)该反应的平衡常数K的表达式为:K= 。当上述反应达到平衡后 ,加入CCl4萃取I2,且温度不变,上述平衡 移动(选填:向右、 向左、不)。
(2)上述反应的正向反应速率和I 、Fe
、Fe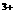 的浓度关系为:V=K[C(I-)]m[C (Fe
的浓度关系为:V=K[C(I-)]m[C (Fe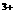 )]n(K为常数)
)]n(K为常数)
|
|
C (I )mol/L )mol/L |
C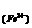 mol/L mol/L |
V(mol/L·S) |
|
(1) |
0.20 |
0.80 |
0.032K |
|
(2) |
0.60 |
0.40 |
0.144K |
|
(3) |
0.80 |
0.20 |
0.128K |
通过所给的数据计算得知:在V=K[C(I-)]m[C(Fe3+)]n 中mn的值为 。
A.m=1 n=1 B.m=1 n=2
C.m=2 n=1 D.m=2 n=2
I?-浓度对反应速率的影响 ,Fe3+浓度对反应速率的影响。(选填:大于、小于、等于)
知识点:本题是一信息试题。
能力点:培养学生自学能力,理解能力和应用能力。
17.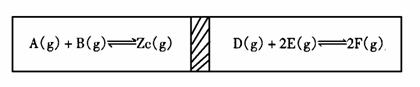 在一个容积固定的反应器中,有一个可左右滑动的隔板,两侧分别进行如下图所示的可逆 反应。各物质的起始加入量如下:A、B、C均为4.0mol,D为6.5mol,F为2.0mol。设E为Xmol。当X在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且
隔板恰好处于反应器的正中位置。请填写如下空白:
在一个容积固定的反应器中,有一个可左右滑动的隔板,两侧分别进行如下图所示的可逆 反应。各物质的起始加入量如下:A、B、C均为4.0mol,D为6.5mol,F为2.0mol。设E为Xmol。当X在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且
隔板恰好处于反应器的正中位置。请填写如下空白:
(1)若X=4.5时,则右侧反应在起始时间 (填“正反应”“逆 反应”)方向进行。欲使起始反应维持向该方向进行,则X的最大取值应小于 。
(1) 若X分别为4.5和5.0时,则在这两种情况下,为反应达平衡时,A的物质的量是否相等?
(填“相等”、“不相等”或“不能确定”)。其理由是 。
知识点:本题是一道信息试题,涉及到外界条件对化学平衡的影响及关于化学平衡的相关计 算。
能力点:培养学生自学能力、综合能力。
16.某温度下,在1L密闭容器中反应N2+3H2 2NH3达到平衡。当N2、H2、NH3的初始加入的物质的量分别为X=1mol,Y=3mol,Z=0mol,达平衡时这三种气体的物
质的量分别为A、B、Cmol,只改变初始物质的加入量,而要求A、B、C总量维持不变,请填
写下列各空。
2NH3达到平衡。当N2、H2、NH3的初始加入的物质的量分别为X=1mol,Y=3mol,Z=0mol,达平衡时这三种气体的物
质的量分别为A、B、Cmol,只改变初始物质的加入量,而要求A、B、C总量维持不变,请填
写下列各空。
(1)若X=0,Y=0,Z= 。
(2)若X=0.75,Y= ,Z= 。
(3)X、Y、Z应该满足的一般条件(用两个联立方程表示) 或 。
知识点:本题是一道关于化学平衡的综合试题,涉及到等效平衡,元素守恒及化学平衡的有关计算。
能力点:考查学生综合思维能力。
15.反应A(g)+3B(g) 2C(g)+2D(g)在四种不同情况下的反应速率分别为①VA=0.1 5mol/L·S②VB=0.6mol/L·S③VC=0.4mol/L·S④VD=0.45mol/L·S该反应进行的快慢顺序为
2C(g)+2D(g)在四种不同情况下的反应速率分别为①VA=0.1 5mol/L·S②VB=0.6mol/L·S③VC=0.4mol/L·S④VD=0.45mol/L·S该反应进行的快慢顺序为
知识点:本题考查化学反应速度的表示方法。
能力点:培养学生理解能力。
14.勒沙特列原理适用于( )
A.整个动态平衡 B.仅仅是平衡时的化学反应
C.一切化学反应 D.非动态平衡系统
知识点:本题考查勒沙特列原理的适用范围
能力点:培养学生理解、记忆能力
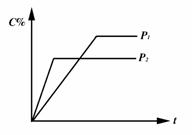
13.对于达到平衡的反应:2A(g)+B(g)[FYKN]nC(g),符合右图所示的结论是( )
A.P1>P2,n>3 B.P1>P2,n<3
C.P1<P2,n>3 D.P1<P2,n<3
知识点:本题考查外界条件对化学平衡的影响
能力点:培养学生正确识图能力
12.在一密闭容器中,用等物质的量的A和B发生如下反应:
A(g)+2B(g)  2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的 量相等,则这时A的转化率为:(
)
2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的 量相等,则这时A的转化率为:(
)
A.40% B.50% C.60% D.70%
 知识点:本题考查有关化学平衡及其转化率的相关计算
知识点:本题考查有关化学平衡及其转化率的相关计算
能力点:培养学生计算能力
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com