
题目列表(包括答案和解析)
6、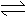 在PCl5(g) PCl3(g)+Cl2(g),达到平衡后,其它条件不变,向平衡体系中加入37Cl2,达到新平衡后,含37Cl的PCl3的物质的量与原平衡相比
在PCl5(g) PCl3(g)+Cl2(g),达到平衡后,其它条件不变,向平衡体系中加入37Cl2,达到新平衡后,含37Cl的PCl3的物质的量与原平衡相比
A、增大 B、减小 C、不变 D、不能确定
5、对处于化学平衡的体系,以化学平衡与化学反应速率的关系可知:
A、化学反应速率变化时,化学平衡一定发生移动。
B、化学平衡发生移动时、化学反应速率一定变化。
C、正反应进行的程度大、正反应速率一定大。
D、只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况。
4、在一个固定体积的密闭容器中,放入mmol的A和nmol的B,发生如下反应:
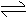 mA(g)+nB(g)
PC(g),平衡时C的浓度是wmol·L-1,若维持容器的体积不变,起始时放入amolA、bmolB和cmolC,要使平衡时C的浓度仍为wmol·L-1,则a、b、c必须满足的条件是
mA(g)+nB(g)
PC(g),平衡时C的浓度是wmol·L-1,若维持容器的体积不变,起始时放入amolA、bmolB和cmolC,要使平衡时C的浓度仍为wmol·L-1,则a、b、c必须满足的条件是
A、a:b:c=m:n:p B、a:b=m:n和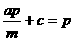
C、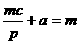 和
和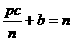 D、a=
D、a=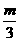 , c=
, c=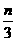 和c=
和c=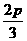
3、现有三个体积相等的密闭容器中都进行如下反应:
 CO2+H2 CO+H2O(g),反应所处的温度相同,但反应的起始浓度不同,其中甲:
CO2+H2 CO+H2O(g),反应所处的温度相同,但反应的起始浓度不同,其中甲:
[H2]=[CO]=amol 乙:[CO2]=amol [H2]=2amol 丙[CO2]=[H2]=[H2O]=amol,达到平衡时,CO的浓度由大到小的顺序排列正确的是
A、丙>甲>乙 B、甲>乙>丙 C、乙>丙>甲 D、乙>甲>丙
2、在2L密闭容器中,盛有2mol X和2molY物质进行如下反应:
 X(s)+3Y(g)
Z(g),当反应进行到10s后,测得生成0.5mol Z,这期间的平均反应速率为
X(s)+3Y(g)
Z(g),当反应进行到10s后,测得生成0.5mol Z,这期间的平均反应速率为
A、vX=0.05mol·s-1 B、vX=0.025mol·L-1·s-1
C、vy=0.05mol·L-1·s-1 D、vy=0.075mol·L-1·s-1
1、 对于反应A2+3B2 2AB3以下表示的反应速率中,速率最大的是
对于反应A2+3B2 2AB3以下表示的反应速率中,速率最大的是
A、vA=0.4mol·L-1min-1 B、vB=0.8mol·L-1min-1
C、v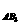 =0.6mol·L-1min-1
D、v
=0.6mol·L-1min-1
D、v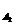 =0.01mol·L-1·S-1
=0.01mol·L-1·S-1
1、 选择适宜的条件:根据N2+3H2 2NH3+Q这一反应的特点,运用化学反应速
选择适宜的条件:根据N2+3H2 2NH3+Q这一反应的特点,运用化学反应速
率和化学平衡的理论来选择适宜条件。该反应为可逆、体积减小、正反应为放热等特点。
(1)适宜的压强:为何强调适宜?压强越大、有利于NH3的合成,但太大,所需动力大,材料强度高,设备制造要求高,成本提高,选择2×107~5×107Pa压强。
 思考:工业上生产H2SO4:2SO2(g)+O2(g) 2SO3(g)为何不采用加压方法?(因为在常压下SO2的转化率已达91%,不需要再加压)
思考:工业上生产H2SO4:2SO2(g)+O2(g) 2SO3(g)为何不采用加压方法?(因为在常压下SO2的转化率已达91%,不需要再加压)
(2)适宜的温度:温度越低越有利于NH3的合成,为何还要选择5000C高温?因为温度越低,反应速率越小,达平衡时间长,单位时间产量低,另外5000C时,催化剂活性最大。
(3)使用催化剂
(4)及时分离出NH3,并不断补充N2和H2(N2要过量,提高成本较高的H2转化率)
[能力训练]
3、影响化学平衡的条件
(1)浓度:增大反应物浓度、平衡向正反方向移动,
减小反应物浓度,平衡向逆反方向移动。
上述变化可用速率--时间图象来说明。
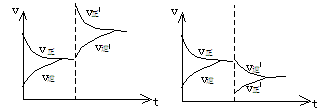
 例:在一恒容密闭容器中,反应A(g)+B(g) C(g)达到平衡,若增大A的浓度,使
例:在一恒容密闭容器中,反应A(g)+B(g) C(g)达到平衡,若增大A的浓度,使
平衡右移,并达到新的平衡,下列说法正确的是
A、A的浓度一定比原平衡大 B、A的转化率增大
C、C的百分含量一定大于原平衡C的百分含量 D、B的转化率一定增大
解析:增大A的浓度,尽管平衡右移,但加入的A不可能全部转化。平衡时A的浓度一定比原平衡大,而A的转化率不一定增大。因为A的总量在增大。同理C的百分含量也不一定增大。而平衡右移B的转化率一定增大,正确答案A、D。
(2)压强--要有气态物质存在,改变压强,才可能使平衡移动。
 例 2NO2(g) N2O4(g) 增大压强平衡向正方向移动,混合气体的颜色先变深后变
例 2NO2(g) N2O4(g) 增大压强平衡向正方向移动,混合气体的颜色先变深后变
浅。
思考:①上述平衡体系,增大压强、速率--时间图象如何表示?
②上述平衡体系颜色a,增大压强瞬间颜色为b,达到新平衡时,颜色为c,则颜色最深的为______,最浅的为______。
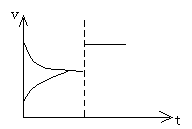
 ③H2(g)+I2(g) 2HI,达到平衡后,加压,速率--时间图象如何变化?混合气体颜色如何变化?
③H2(g)+I2(g) 2HI,达到平衡后,加压,速率--时间图象如何变化?混合气体颜色如何变化?
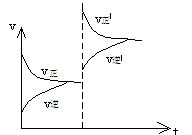 (① ②b、a ③
(① ②b、a ③
平衡不移动,颜色变深)
(3)温度--所有化学反应均具有能量变化,温度改变,化学平衡一定移动。
例:1molX(g)和1molY(g)和催化剂一起放入反应容器中、发生如下反应:
X(g)+Y(g) Z(g),经过一段时间后,产物Z的压强与温度关系如图:
(1)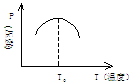 当温度T<T0时,v正和v逆关系?
当温度T<T0时,v正和v逆关系?
(2)当温度T>T0时,v正和v逆关系?
(3)该反应的正反应是吸热还是放热反应?指出判断依据。
解析:当温度T<T0时,随着温度升高,Z的压强逐渐增大,说明反应向正方向进行,v正>v逆,而当T=T0时,恰好处于平衡状态,v正=v逆。正反应显然为放热反应,因为T0是处于平衡状态,温度再升高,Z的压强在减小,说明平衡破坏,反应向逆方向进行。
(4)催化剂--只改变反应速率,而平衡不移动。
 思考:A(g)+3B(g) 2C(g)+Q(Q>0)达到平衡,改变下列条件,正反应速率始终增大,直达到新平衡的是
思考:A(g)+3B(g) 2C(g)+Q(Q>0)达到平衡,改变下列条件,正反应速率始终增大,直达到新平衡的是
A、升温 B、加压 C、增大[A] D、降低[C] E、降低[A]↓
[注意正反应速率始终增大,这关键词,D、E就不必改虑,因为降低浓度,不管平衡如何移动,v正均要降低。其次最好画出v-t图,就能清楚看出正确答案。
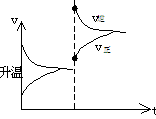
v正始终增大(尽管平衡左移)
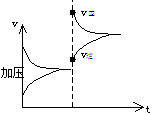
v正突然增大,但又逐渐减小,同理C答案
也不合题意,正确答案为A]
2、


 反应A2(g)+B2(g) 2AB(g)达到化学平衡的标志是
反应A2(g)+B2(g) 2AB(g)达到化学平衡的标志是
A、 单位时间内消耗nmolA同时消耗nmolB.
B、单位时间内消耗nmol A同时生成了nmolB.
C、压强不随时间变化而改变。
D、 单位时间打断nmol A-A共价键同时打断2nmol A-B共价键。
(答:B、D)
2、化学平衡状态
特点:“等”:v正=v逆,这是反应是否处于平衡的根本原因。
“动”:动态平衡,v正=v逆≠0,正、逆反应仍在进行。
“定”:达到化学平衡,各组分的百分含量不变。
“变”:化学平衡是相对的,外界条件改变,化学平衡可能被破坏。
思考1、v正=v逆,可否理解成单位时间内生成物浓度的变化和反应物浓度变化表示的
反应速率数值相等?
(不能,指的是同一物质在单位时间内消耗的量与生成的量相等)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com