
题目列表(包括答案和解析)
3.原子核外的M电子层和L电子层最多可容纳的电子数( )。 (A)大于 (B)小于 (C)等于 (D)不能肯定 4.钢和生铁中碳的百分含量( )。 (A)大于 (B)小于 (C)等于 (D)不能肯定 5.相同温度下的0.1摩/升和0.01摩升CH3COOH溶液中,CH3COOH的电离度( )。 (A)大于 (B)小于 (C)等于 (D)不能肯定 二、选择题。(本小题包括15小题,每小题3分,共45分,每小题有一个或两个选项符 合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。) 6.科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素中最重 的原子。关于该新元素的下列叙述正确的是( )。
(A)其原子核内中子数和质子数都是112 (B)其原子核内中子数为165,核外电子数为112 (C)其原子质量是12C原子质量的277倍 (D)其原子质量与12C原子质量之比为277:12 7.关于磷的下列叙述中,正确的是( )。 (A)红磷没有毒性而白磷剧毒 (B)白磷在空气中加热到260℃可转变为红磷 (C)白磷可用于制造安全火柴 (D)少量白磷应保存在水中 8.把三氯化铁溶液蒸干灼烧,最后得到的固体产物是( )。 (A)无水三氯化铁 (B)氢氧化铁 (C)氧化亚铁 (D)三氧化二铁 9.将1体积选项中的一种气体与10体积O2混和后,依次通过盛有足量浓NaOH溶液的洗 气瓶和盛有足量灼热铜屑的管子(假设反应都进行完全),最后得到的尾气是( ) (A)Cl2 (B)CO (C)CO2 (D)N2 10.关于化学键的下列叙述中,正确的是( )。 (A)离子化合物可能含共价键 (B)共价化合物可能含离子键 (C)离子化合物中只含离子键 (D)共价化合物中不含离子键 11.下列各组离子,在强碱性溶液中可以大量共存的是( )。 (A)K+、Na+、HSO3-、Cl- (B)Na+、Ba2+、AlO2-、NO3-
(C)NH4+、K+、Cl-、NO3- (D)K+、Na+、ClO-、S2- 12.下列离子方程式不正确的是( )。 (A)氨气通入稀硫酸溶液中NH3+H+=NH4+ (B)二氧化碳通入碳酸钠溶液中CO2+CO32-+H2O=2HCO3- (C)硫酸铝溶液跟偏铝酸钠溶液起反应Al3++3AlO2-+6H2O=4Al(OH)3↓
(D)氯气通入冷的氢氧化钠溶液中2Cl2+2OH-=3Cl-+ClO-+H2O
13.把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(固)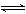 Ca2++2OH-
Ca2++2OH-
加入以下溶液可使Ca(OH)2减少的是( )。
(A)Na2S溶液 (B)AlCl3溶液 (C)NaOH溶液 (D)CaCl2溶液 14.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确
的是( )。 (A)X的原子序数比Y的小 (B)X原子的最外层电子数比Y的大 (C)X的原子半径比Y的大 (D)X元素的最高正价比Y的小
 根据以下叙述,回答1-2小题。
1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家。大气中的臭氧层可滤除大量的紫外光,保护地球上的生物。氟利昂(如CCl2F2可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应为:
根据以下叙述,回答1-2小题。
1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家。大气中的臭氧层可滤除大量的紫外光,保护地球上的生物。氟利昂(如CCl2F2可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3)。有关反应为:
1.在上述臭氧变成氧气的反应过程中,Cl是( )。
(A)反应物 (B)生成物 (C)中间产物 (D)催化剂
2. O3和O2是( )。
(A)同分异构体 (B)同系物 (C)氧的同素异形体 (D)氧的同位素
请分别比较3-5三个小题中前后两个数值的相对大小。选择(A)、(B)、(C)、(D)表 示前者和后者的关系。
37.(5分)
 (每空1分,共5分)
七、(本题包括2小题,共12分)
38.(5分)
2Na2O2+2H2O=4NaOH+O2↑
Na2O2+H2O=2NaOH (1分)
[解法一]设混和物中含x摩Na2O2和y摩Na2O
(每空1分,共5分)
七、(本题包括2小题,共12分)
38.(5分)
2Na2O2+2H2O=4NaOH+O2↑
Na2O2+H2O=2NaOH (1分)
[解法一]设混和物中含x摩Na2O2和y摩Na2O
 |
(1分) |
|
(1分) |
解得:x=0.50 Na2O2质量=0.50×78=39(克) (1分) y=0.50 Na2O质量=0.50×62=31(克) (1分) [解法二]设混合物中Na2O2质量为x克,Na2O质量为(70-x)克
 |
(2分) |
解得:x=39 Na2O2质量为39克 (1分) 70-x=31 Na2O2质量为31克 (1分) [解法三]设混合物中Na2O2质量为x克,Na2O质量为(70-x)克

解得:x=39 Na2O2质量为39克 (1分) 70-x=31 Na2O2质量为31克 (1分) 39.(7分)解: (1)[Ag+]=((0.836/312)/0.100)×2=0.0536(摩/升) (2)∵Ag2SO4固体过量,该溶液仍为Ag2SO4饱和溶液. ∴[Ag+]=0.0536(摩/升) (2分) [说明]只要答出[Ag+]=0.0536摩/升,未说明原因,同样给分. [解题思路]Ag2SO2饱和溶液的浓度与BaCl2溶液的浓度相等,但体积比为4:1,因而参加反应的 Ag2SO4的质量仅为原溶液中Ag2SO4质量的1/4.根据原加入的水和Ag2SO4固体的质量以及Ag2SO4 的溶解度可判断,即使BaCl2反应后,尚有多余的Ag2SO4固体.因而最后溶液仍为Ag2SO4饱和溶液, [Ag+]不变,(以上内容不要求考生在卷面上回答.) (3)设加入的BaCl2溶液的体积为V(升) ((6.24/312)-0.0268×V/(0.200+V))×2=0.0200(摩/升) (3分) V=0.489(1分)
0.0200摩/升?
答案及评分标准
一、(本题包括5小题,每小题1分,共5分)
1.B 2.D 3.D 4.B 5.C
二、(本题包括18小题,每小题2分,共36分)
6.A、C 7.C 8.B、C 9.B、C 10.D
11.B 12.A 13.A、C 14.D 15.B、C
16.B 17.C 18.A 19.C 20.A
21.A、C 22.C 23.A、C
三、(本题包括5小题,每小题3分,共15分)
24.B、C 25.C 26.A
27.D 28.D
四、(本题包括2小题,共8分)
29.(2分)A.D(全对才给分,只答一个,答对也不给分)
30.(6分)
2NaB+2H2SO4+MnO2  2NaHSO4+MnSO4+2H2O+Br↑或
2NaB+2H2SO4+MnO2
2NaHSO4+MnSO4+2H2O+Br↑或
2NaB+2H2SO4+MnO2  Na2HSO4+MnSO4+2H2O+Br↑(1分)
[若写2NaB+3H2SO4(浓)= 2Na2HSO4+SO4+2H2O+Br2↑
若分步写:NaB+H2SO4 (浓)
Na2HSO4+MnSO4+2H2O+Br↑(1分)
[若写2NaB+3H2SO4(浓)= 2Na2HSO4+SO4+2H2O+Br2↑
若分步写:NaB+H2SO4 (浓) NaHSO4+HBr↑或
(2NaB+H2SO4 (浓)
NaHSO4+HBr↑或
(2NaB+H2SO4 (浓) Na2SO4+2HBr↑)
4HBr+MnO2(浓)
Na2SO4+2HBr↑)
4HBr+MnO2(浓) MnBr2+2HO+Br2↑这两步反应全对才给1分,只对1个不给分].
冷凝 (1分)
(1)吸收未冷凝的气体
(1分)
(2)溴蒸气会腐蚀橡皮塞和橡皮管
(1分)
(3)答:当气体被吸收时,液体上升到漏斗中.由于漏斗的容积较大,导致烧杯中液面下降,使漏斗口脱
离液面,漏斗中的液体又流回烧杯中,从而防止了倒吸. (2分)
评分要点:①漏斗容积较大(1分),②烧杯中液面下降,使漏斗口脱离液面(或使液面低于漏斗口)
(1分).未答出要点含意的不给分.
五(本题包括4小题,共12分)
31.(3分)
(1)FeS+2HCl=FeCl2+H2S↑或FeS+H2SO4=FeSO4+H2S↑(用离子方程式表示也同样给分)(1分)
(2)SO2 (1分)
(3)Na2SO3 (1分)
32.(2分)小于 (1分)
答:甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,故甲瓶氨水的电离度比乙瓶氨水的电离度小,所以甲、乙
两瓶氨水中[OH-]之比小于10. (1分)
33.(3分)C (1分)
答:首先,因为Na2CO3=2Na++CO32-,CO32-+H+=HCO3-(只写后一方程式也对)
所以溶液中HCO3-的浓度渐增大(方程式和文字说明两者缺一不给分) (1分)
而后,因为HCO3-+H+=H2CO3,H2CO3=H2O+CO2↑
写HCO3-+H+=H2O+CO2↑
也对
所以溶液中HCO3-的浓度减小。(方程式和文字说明两者缺一就不给分) (1分)
34.(4分)
(1)c=2 (1分)
(2)b=0.25和c=1.5(两空都对才给分) (1分)
(3)a+c=2
(1分)
2b+c=2
(1分)
六、(本题包括3小题,共12分)
35.(3分)
CH2=CHCN,CH2=CHCH=CH2,CH2=CHC6H5
(每空1分,共3分)
36.(4分)
MnBr2+2HO+Br2↑这两步反应全对才给1分,只对1个不给分].
冷凝 (1分)
(1)吸收未冷凝的气体
(1分)
(2)溴蒸气会腐蚀橡皮塞和橡皮管
(1分)
(3)答:当气体被吸收时,液体上升到漏斗中.由于漏斗的容积较大,导致烧杯中液面下降,使漏斗口脱
离液面,漏斗中的液体又流回烧杯中,从而防止了倒吸. (2分)
评分要点:①漏斗容积较大(1分),②烧杯中液面下降,使漏斗口脱离液面(或使液面低于漏斗口)
(1分).未答出要点含意的不给分.
五(本题包括4小题,共12分)
31.(3分)
(1)FeS+2HCl=FeCl2+H2S↑或FeS+H2SO4=FeSO4+H2S↑(用离子方程式表示也同样给分)(1分)
(2)SO2 (1分)
(3)Na2SO3 (1分)
32.(2分)小于 (1分)
答:甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,故甲瓶氨水的电离度比乙瓶氨水的电离度小,所以甲、乙
两瓶氨水中[OH-]之比小于10. (1分)
33.(3分)C (1分)
答:首先,因为Na2CO3=2Na++CO32-,CO32-+H+=HCO3-(只写后一方程式也对)
所以溶液中HCO3-的浓度渐增大(方程式和文字说明两者缺一不给分) (1分)
而后,因为HCO3-+H+=H2CO3,H2CO3=H2O+CO2↑
写HCO3-+H+=H2O+CO2↑
也对
所以溶液中HCO3-的浓度减小。(方程式和文字说明两者缺一就不给分) (1分)
34.(4分)
(1)c=2 (1分)
(2)b=0.25和c=1.5(两空都对才给分) (1分)
(3)a+c=2
(1分)
2b+c=2
(1分)
六、(本题包括3小题,共12分)
35.(3分)
CH2=CHCN,CH2=CHCH=CH2,CH2=CHC6H5
(每空1分,共3分)
36.(4分)
 |
(每空1分,共2分) |
|
(每空1分,共2分) |
量百分比浓度为50%.试分别写出过氧化钠和氧化钠跟水反应的化学方程式,并计算原混和物中过氧化钠和氧化钠的质量各为多少克.
39.(7分)硫酸银的溶液解度较小,25℃时,每100克水仅溶解0.836克. (1)25℃时,在烧杯中放入6.24克硫酸银固体,加200克水,经充分溶解后,所得饱和溶液的
体积为200毫升. 计算溶液中Ag+的摩尔浓度. (2)若在上述烧杯中加入50毫升0.0268摩/升BaCl2溶液,充分搅拌,溶液中Ag+的摩尔浓
度是多少? (3)在(1)题烧杯中需加入多少升0.0268摩/升BaCl2溶液,才能使原溶液中Ag+浓度降低至
制取硫代硫酸钠.图中的A、B、C和D是硫单质或硫的化合物,其它不含硫的反应产物已被略
去,各步反应可以添加必要的试剂.

请填写下列空白: (1)反应(Ⅰ)的化学方程式是: ______________. (2)物质B的分子式是: _______________. (3)物质D的分子式: ______________.
32.(2分)甲、乙两瓶氨水的浓度分别为1摩/升和0.1摩/升,则甲、乙两瓶氨水中[OH-]之比
_______ (填大于、等于或小于)10.请说明理由. 33.(3分)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程
中,溶液的碳酸氢根离子浓度变化趋势可能是:(A)逐渐减小;(B)逐渐增大;(C)先逐渐增大,
而后减小;(D)先逐渐减小,而后增大.你的选择是_______, (填正确选 项的标号.)试用化学
方程式和简要文字表述其理由. 34.(4分)在一定温度下,把2摩SO2和1摩O2通入一个一定容积的密闭的容器里,发生如下反应:

当此反应进行到一定程度时,反应混和物就处于化学平衡状态.现在该容器中,维持温度不变,令a、 b、c分别代表初始加入的SO2、O2和SO3的物质的量(摩).如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同.请填写下列空白: (1)若a=0,b=0,则c= ______. (2)若a=0.5,则b=_______ 和c=______ . (3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个
只含b和c): ____________. 六、(本题包括3小题,共12分) 35.(3分)工程塑料ABS树脂(结构简式如下),合成时用了三种单体.

这三种单体的结构简式分别是:______ 、______ 、______ . 36.(4分)液晶是一类新型材料.MBBA是一种研究得较多的液晶化合物.它可以看作是由醛A和 胺B去水缩合的产物.

(1)对位上有-C4H9的苯胺可能有4个异构体,它们是:
CH3CH2CH2CH2- -NH2、(CH3)2CH2CH2-
-NH2、(CH3)2CH2CH2- -NH2
.
(2)醛A的异构体甚多.其中属于酯类化合物,而且结构式中有苯环结构的异构体就有6个,它
-NH2
.
(2)醛A的异构体甚多.其中属于酯类化合物,而且结构式中有苯环结构的异构体就有6个,它
们是:
 37.(5分)从环己烷可制备1,4-环己二醇的二醋酸酯.下面是有关的8步反应(其中所有无机
37.(5分)从环己烷可制备1,4-环己二醇的二醋酸酯.下面是有关的8步反应(其中所有无机
产物都已略去):

其中有3步属于取代反应、2步属于消去反应、3步属于加成反应.反应①、______ 和____属于取代反应.化合物的结构简式是:B______、C ______.反应④所用试剂和条件是 __
24.(12分)向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。
(2)若通入CO2气体为2.24L(标准状况下),得到11.9g的白色团体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少?
23.(7分)在一定条件下,使H2和O2的混合气体26g充分发生反应。所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。求原混合气体中O2和H2的质量。
22.(l0分)卤代烃在碱性醇溶液中能发生消去反应。例如

该反应式也可表示为

下面是八个有机化合物的转换关系

请回答下列问题:
(1)根据系统命名法,化合物A的名称是 。
(2)上述框图中,①是 反应,③是 反应。(填反应类别)
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式
。
(4)C2的结构简式是 。F1的结构简式是 。
F1和F2互为 。
(5)上述八个化合物中,属于二烯烃的是 。二烯烃的通式是 。
21.(6分)乙酸苯甲酯对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业。乙酸苯甲酯可以用下面的设计方案合成。

(1)写出A人的结构简式:
A ,C:
(2)D有很多同分异构体,含有酯基和-取代苯结构的同分异构体有五个,其中三个的结构简式是

请写出另外两个同分异构体的结构简式:
和
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com