
题目列表(包括答案和解析)
29、在KClO3的分解反应里,MnO2的催化问题,到目前还没有肯定的解释,鉴于制得的氧气里有氯气的气味,生成的氯化钾带紫红色,因而认为反应过程如下:

 I:2KClO3+2MnO2 △ 2A+B↑+C↑
I:2KClO3+2MnO2 △ 2A+B↑+C↑

 II:2A △ D+MnO2+C↑
II:2A △ D+MnO2+C↑

 III:B+D △ 2KCl+MnO2+C↑
III:B+D △ 2KCl+MnO2+C↑
(1)写出A、B、C、D的化学式:
A_____________B_____________C____________D______________
(2)第一步反应中,氧化产物是(填化学式)______________
(3)第III步反应的化学方程式为_________________________
28、已知:Na2HPO4溶液PH值约为9,NaH2PO4溶液PH值约为6,又知:在Na2HPO4溶液中滴加AgNO3溶液时,有Ag3PO4黄色沉淀生成,溶液则由反应前的弱碱性转变为反应后的弱酸性。
(1)Na2HPO4溶液呈弱碱性的原因是______________________
表示这一反应的离子方程式是________________________
(2)在Na2HPO4溶液中加入AgNO3溶液产生Ag3PO4沉淀的离子方程式是______________
27、 三氯化铁是中学化学实验中必不可少的重要试剂,某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如右图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液显浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水并使多余的HNO3分解,再降温结晶得FeCl3·6H2O晶体,请填写下列空白:
三氯化铁是中学化学实验中必不可少的重要试剂,某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如右图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液显浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水并使多余的HNO3分解,再降温结晶得FeCl3·6H2O晶体,请填写下列空白:
(1)从B导管收集产生的气体可采用的方法是_____________________
(2)滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是__________________
(3)烧杯内放过量稀HNO3的原因是_____________,离子方程式为____________________
(4)整个实验过程中,活塞开关a都必须打开,原因之一是___________________之二是
_____________________________之三是________________________________
(5)用降温结晶的方法制得FeCl3·6H2O,而不用直接蒸干的方法来制得晶体的理由是
___________________________________________________
(6)该实验在进行时必须在_______________________中进行。
26、如右图装置除用作洗气外,此装置还可用于
(1)排空气法收集气体,若收集CO2气体,进气口为________(填a或b)
(2)若瓶中装满水,可用于_________,这里的进气口为____________
(3)若瓶中所盛气体为CO(即为CO贮气瓶),如要产生平稳的CO气流,则可将______
(填a或b)接在自来水龙头上,然后__________________,即可排出实验中所需要的CO。
25、室温下PH=a的盐酸体积 为VaL,与PH=b的电离度为α的氨水VbL恰好完全中和,则Va/Vb的值是( )
A、1
B、 C、
C、 D、
D、
24、现在大量使用的塑料,如聚苯乙烯,因难以分解而造成的“白色污染”甚为严重,铁



 CH3 O
CH3 O
道部下令全国铁路餐车停止使用聚苯乙烯制造的餐具,而改用可降解塑料[O-CH-C-]n,该塑料在乳酸菌作用下迅速分解为无毒物质。下列有关可降解塑料叙述正确的是( )
A、可降解塑料是一种纯净物 B、其式量为72

 O
O
C、经缩聚反应生成 D、其单体是CH3-C-COOH
23、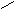


 aX(g)+bY(g) cZ(g)+dW(g)反应5min达到平衡时,X减少nmol·L-1,Y减少
aX(g)+bY(g) cZ(g)+dW(g)反应5min达到平衡时,X减少nmol·L-1,Y减少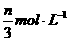 。若将体系压强增大,W的百分含量不发生变化,则反应中各物质的计量系数之比a:b:c:d为(
)
。若将体系压强增大,W的百分含量不发生变化,则反应中各物质的计量系数之比a:b:c:d为(
)
A、1:3:1:2 B、1:3:2:2 C、3:1:2:1 D、3:1:2:2
22、将17.6g FeS固体置于200mL 3.0mol·L-1的盐酸中制备H2S气体。反应完全后,若溶液中H2S溶液为0.10mol·L-1,假定溶液体积不变,则溶液中H+的物质的量浓度最接近( )
A、1mol·L-1 B、1.1mol·L-1 C、1.2mol·L-1 D、在1.1~1.2mol·L-1之间
21、由IIIA元素A和VIA族元素B组成的阴离子结构如下图,所带电荷x、y、z依次为



 B B x- B
y-
B z-
B B x- B
y-
B z-







 A A
A一 B A B
A
A A
A一 B A B
A










 B B B
B A一B
B B
B B B
B A一B
B B
 A
A
B B
A、2,3,4 B、2,3,2 C、5,6,4 D、4,3,2
20、 卤代反应的难易程度与烃分子中氢原子所处的状况有关,已知处于“-CH3”、“-CH2-”、
卤代反应的难易程度与烃分子中氢原子所处的状况有关,已知处于“-CH3”、“-CH2-”、
 “-CH”三种状况的氢原子,在一定条件下发生卤代反应时的活性之比为1:3.8:5。如果控制在此条件下使2-甲基丙烷发生一氯代反应,则反应完全后产生(CH3)3CCl占全部一氯代物的质量分数为(
)
“-CH”三种状况的氢原子,在一定条件下发生卤代反应时的活性之比为1:3.8:5。如果控制在此条件下使2-甲基丙烷发生一氯代反应,则反应完全后产生(CH3)3CCl占全部一氯代物的质量分数为(
)
A、35.7% B、50% C、16.7% D、83.3%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com