
题目列表(包括答案和解析)
20. 在下列两图中,V表示反应速率,C%表示某反应物在平衡体系中的体积分数,P表示压强,t表示反应时间,图(I)为温度一定时,压强与反应速率的关系曲线;图(Ⅱ)为压强一定时,在不同时间的C%与温度的关系曲线。在下列反应中,同时符合以上两个图象的是( ) 20. A
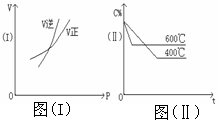 A.4NH3(气)+5O2(气)
A.4NH3(气)+5O2(气) 4NO(气)+6H2O(气)△H =-808.7kJ
4NO(气)+6H2O(气)△H =-808.7kJ
B.N2O3(气)  NO2(气)+NO(气) △H = 41.8kJ
NO2(气)+NO(气) △H = 41.8kJ
C.3NO2(气)+H2O(液)  2HNO3(液)+NO(气)△H =-261.3kJ
2HNO3(液)+NO(气)△H =-261.3kJ
D.CO2(气)+C(固) 2CO(气) △H = 171.4kJ
2CO(气) △H = 171.4kJ
选择题答题栏:
19、20mL 1mol/L醋酸溶液跟40mL 0.5mol/L氢氧化钠溶液混合,所得溶液中离子的浓度由大到小的顺序是 ( )19. AB
(A) C(Na+)>C(CH3COO- )>C(OH-)>C(H+)
(B) C(Na+)=C(CH3COO- )+ C(CH3COOH )
(C) C(Na+)>C(OH-)>C(CH3COO- )>C(H+)
(D) C(Na+)>C(OH-)>C(H+)>C(CH3COO- )
18.砷为第四周期VA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )18. D
A.砷在通常状况下是固体 B.可以有-3、+3、+5等多种化合价
C.As2O5对应水化物的酸性比H3PO4弱 D.砷的还原性比磷弱
17.用NA表示阿伏加德罗常数,下列叙述正确的是 ( )
(A)17g氨中共价键的数目为NA 17. BC
(B)aL标准状况下的HCl气体的分子数为a NA /22.4
(C)0.1mol/L的Na2SO4溶液中,单位体积内Na+的个数为0.2 NA /L
 (D)用惰性电极电解NaCl溶液,每生成NaOH a g,电路中通过的电子数为a/
NA
(D)用惰性电极电解NaCl溶液,每生成NaOH a g,电路中通过的电子数为a/
NA
16.将CO、O2混合气200mL置于密闭容器中点爆,再恢复至原状况,气体变为150ml,则原混合气中CO的体积可能为 ( )16. BC
(A)50ml (B)100mL (C)150ml (D)180ml
35、向某二价金属M的氢氧化物澄清溶液100mL中加入过量的NaHCO3溶液,生成MC3O3沉淀,过滤,将沉淀置于足量盐酸中,在标况下收集到4.48L气体。将滤液加水稀释至250mL,取出25mL恰好与20mL盐酸完全反应,在标况下收集到1.12L气体。
(1)写出M的氢氧化物澄清溶液与过量NaHCO3溶液反应的化学方程式
(2)要计算M的原子量,你认为还必须提供下列哪项数据(填序号)
a、M的氢氧化物溶液的物质的量浓度(设为2mol/L)
b、M的碳酸盐的质量(设为39.4g)
c、与M的碳酸盐反应的盐酸的物质的量浓度
d、题设条件充足,不需要补充数据
(3)根据你的选择,计算M的原子量和加入NaHCO3的溶液中含NaHCO3的质量。
34、在标准状况下,将123.2mL N2和CO2的混合气体缓慢通过足量的Na2O2粉末,可发现Na2O2增重0.14g,所得到的混合气体充入集气瓶中,放电使之充分反应后,将集气瓶倒置于水槽中(假定各步能完全反应,没有损失)试计算:
(1)原混合气体中N2和CO2的物质的量之比;
(2)倒置于水槽中,充分反应后,集气瓶中剩余气体的物质的量。
33、已知卤代烃在碱性条件下共热可水解成醇,如:
 R-X+H2O NaOH R-OH+HX(R-烃基,X-卤素原子),电解羧酸碱金属盐的溶液,
R-X+H2O NaOH R-OH+HX(R-烃基,X-卤素原子),电解羧酸碱金属盐的溶液,
△
可得到脱去羧基后的有机物。例如:
 2CH3COOK+2H2O 电解 C2H6+2CO2↑+H2↑+2KOH
2CH3COOK+2H2O 电解 C2H6+2CO2↑+H2↑+2KOH
 (1)现将CH3COOK改为CH2COOK溶液,请写出电解后留下的混合物A中的主要成分
(1)现将CH3COOK改为CH2COOK溶液,请写出电解后留下的混合物A中的主要成分
Cl
为
(2)A有以下衍生关系:



 混合物A 加热 B 氧化 C 氧化 D +B E
混合物A 加热 B 氧化 C 氧化 D +B E
浓HSO4,△
B和C的氧化均很完全,D与B以物质的量之比1:1反应生成有机物E,在不同的反应条件下,E的结构可能有多种。若E为一种含有六原子环的结构有机物,则E的结构简式为 ;若E为一种高分子物质,则E的结构简式可表示为 。
31、现有A、B、C三种烷烃,它们的化学式都是C8H18
(1)A不能由任何C8H16的异构体加H2得到A的名称为________________________
(2)B可以由而且只能由一种C8H16异构体加H2得到,B的结构简式为______________
(3)C可以由而且只能由二种C8H16异构体加H2得到,则C的结构式可能为________或_________________。 O O R






 32、已知下列么应可以发生:R CHO+R
32、已知下列么应可以发生:R CHO+R -C-OH R
-C-OH R -C-O-CH,又知醇和氨都有似水性。现以乙烯为原料合成维纶,其主要步聚如图所示: OH
-C-O-CH,又知醇和氨都有似水性。现以乙烯为原料合成维纶,其主要步聚如图所示: OH
 D
D

 +CH3OH
+CH3OH



 CH2=CH2
+O2
A +CH3OOH B 加聚 C E +H-C-H 维纶
CH2=CH2
+O2
A +CH3OOH B 加聚 C E +H-C-H 维纶





 催化剂 -H2O
+NH3 缩聚 (C5H8O2)n
催化剂 -H2O
+NH3 缩聚 (C5H8O2)n
 F (含六元环)
F (含六元环)
(1)生成A的化学方程式为
(2)由C生成D和E的化学方程式为
(3)E的名称是 。维纶的结构简式为
30、气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数,B、D、E是中学化学中的常见气体。各物质有如图所示的转化关系:






 B 固体甲(单质) D 固体乙 B
B 固体甲(单质) D 固体乙 B
 高温 △
F
高温 △
F

 A 点燃
A 点燃
(足量O2) 固体甲(单质)


 C 高温 E 固体乙
C 高温 E 固体乙

 △ C
△ C
试回答下列问题
(1)若气体A中,X与Y的质量比小于3,则气体A中肯定有(填化学式)______________
(2)若气体A中的分子为线型结构,且X与Y两种元素的质量比数值上等于X的原子量,则A气体燃烧的化学方程式为_________________
(3)C与固体甲在高温下反应的化学方程式为____________________
(4)B、C、E 的沸点从低到高排列的顺序是_____________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com