
题目列表(包括答案和解析)
5.立方烷的结构为 ,其三氯代物共有( )
(A)2种 (B)3种 (C)4种 (D)5种
4.乙烯和乙炔的混合气体点燃完全燃烧,所需氧气的体积是相同条件下混合气体体积的2.8倍,则混合气体中乙烯的体积百分含量可能是( )
 (A)61.71%
(B)38.24%
(C)60%
(D)40%
(A)61.71%
(B)38.24%
(C)60%
(D)40%
3.120°C时,1体积某烃和4体积氧气混合,完全燃烧后恢复到原来的温度和压强,体积不变,该烃分子式中所含的碳原子数不可能是( )
(A)1 (B)2 (C)3 (D)4
2.已知分子式为C12H12的物质A结构简式为 ,A苯环上的二溴代物有9种异
构体,由此推断A苯环上的四溴代物的异构体数目有( )
(A)9种 (B)10种 (C)11种 (D)12种
1.下列有机物的命名正确的是( )
(A)3,3-二甲基丁烷 (B)3-甲基-2-丁烯
 (C)2-乙基丁烷
(D)2,2,3-三甲基丁烷
(C)2-乙基丁烷
(D)2,2,3-三甲基丁烷
23.(8分)已知下列两个热化学方程式;
H2(g)
+  O2(g) == H2O(l );△H = -285.8kJ/ mol
O2(g) == H2O(l );△H = -285.8kJ/ mol
C3H8(g) + 5O2(g) == 3CO2(g) + 4H2O(l);△H = -2220.0 kJ/ mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热5297.4kJ,试计算混合气体中H2和C3H8的体积比;
(2)已知:H2O(l) = H2O(g);△H = +44.0 kJ/ mol,试写出丙烷燃烧生成CO2和水蒸气的热化学方程式。
 24.(6分)某化学小组为了测定石膏(CaSO4·xH2O),即测定x值。做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如下图所示。数据表明当固体的质量为2.72g后不再改变。
24.(6分)某化学小组为了测定石膏(CaSO4·xH2O),即测定x值。做如下实验:将石膏加热使之脱水,加热过程中固体的质量与时间的变化关系如下图所示。数据表明当固体的质量为2.72g后不再改变。
求:(必须写出计算过程)
(1)石膏的化学式;
(2)图像中AB段对应化合物的化学式。
22.(11分)某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用图3所示装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
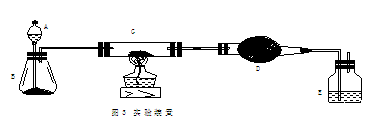
(1)实验目的:________▲_________。
(2)实验用品:仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等,药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等。
(3)实验内容(见表1)。
表1 实验步骤,现象及方程
|
实验步骤 |
实验现象 |
有关化学方程式 |
||||
 在G中加入样品粉末Wg,D中装入药品后并称量为 在G中加入样品粉末Wg,D中装入药品后并称量为 g,连接好仪器后,检查气密性 g,连接好仪器后,检查气密性 |
 |
|
||||
|
打开A的活塞,慢慢滴加溶液 |
▲ |
▲ |
||||
|
对G进行加热,当G中药品充分反应后,关闭A的活塞,停止加热 |
|
|
||||
 冷却后,称量D的质量为 冷却后,称量D的质量为 g g |
|
 |
(4)计算:样品中铜的质量分数=_____▲ ____(用含W, 的代数式表示);
的代数式表示);
(5)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使G中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有学生提出在B与G之间加入一个装置,再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是____▲______。在B与G之间加入的装置可以是______▲_______,其中盛放的药品是_____▲_______。
21. (11分)实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2
(11分)实验室用浓盐酸、二氧化锰共热制氯气,并用氯气和Ca(OH)2制取少量漂白粉。现已知反应:2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O,该反应是放热反应,温度稍高即发生副反应:6Cl2+6Ca(OH)2 Ca(ClO3)2+5CaCl2+6H2O。现有3个同学分别设计的3套实验装置如下图:
(1)写出制取氯气的化学方程式 _▲ ;
(2)请从以下几个方面对甲乙丙3套实验装置的优缺点作出评价,并将符合题目要求的选项的序号填在表中空格中。
a.不容易控制反应速率; b.容易控制反应速率; c.有副反应发生;
d.可防止副反应发生; e.污染环境; f.可防止污染环境
|
|
优
点 |
缺 点 |
|
甲装置 |
▲ |
▲ |
|
乙装置 |
▲ |
▲ |
|
丙装置 |
▲ |
▲ |
(3)上述装置中甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中选取合理的部分,组装一套较完整的实验装置,装置各部分连接顺序是 _▲ (按气流流动的方向)。该组合中还缺少的装置是 _▲ ,
原因是 _▲ ;
(4)实验室若用16mol/L的盐酸100mL与足量的二氧化锰反应,理论上最终生成的次氯
酸钙的物质的量最多不超过 ▲ mol。
20.(6分)铁是自然界里分布最广的金属元素之一,在地壳中的质量约占5%左右。铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe304)、赤铁矿石(主要成分是Fe2O3)等。
(1)写出用赤矿炼铁的主要化学反应方程式________________▲____________________;
(2)红热的铁能跟水蒸气起反应,有一种产物是可燃气体,则其反应方程式为
_____________________________________▲___________________________,
在常温下,铁跟水不起反应。但是,在水和空气里的氧气及二氧化碳等的共同作用下,铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。刷油漆是重要的防腐蚀措施之一,油漆防腐蚀的主要原理是_____________▲________________;
(3)铁元素是人体的重要营养元素,举一例说明铁元素在人体中的重要作用
______________________________________▲______________________________。
19.(6分)在铝表面着色,先应用电解法使铝表面覆上一层氧化铝,方法是用铝件和另一材料作电极,用碳酸氢钠作电解液进行电解。其原理是通电后铝件与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解,从而在铝件表面形成一层较厚的氧化膜。某校研究性学习小组根据上述原理,以铝件和铁棒为电极,一定浓度的碳酸氢钠作电解液进行实验。
(1).铝件表面形成Al(OH)3薄膜的原因 ▲ ;
(2).电解过程中,必须使电解液的pH值保持相对稳定(不能太大,也不能太小)的理由
▲ ;
(3).用碳酸氢钠作电解液,会减缓阴极区溶液pH值的增大,能说明这一原理的离子方程式是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com