
题目列表(包括答案和解析)
2.下列物质:①苯酚 ②淀粉 ③油脂 ④蛋白质 ⑤硝基苯 ⑥明矾 ⑦氯乙烷
⑧皓矾 ⑨水玻璃 ⑩碘化钠。不能发生水解的是 ( )
A.①⑤⑩ B.③⑥⑨ C.②④⑦⑧ D.①②④⑩
1.近几年,国际上提出了:“预防污染”这一概念,绿色化学是“预防污染”的根本手段。针对“吸烟”而言,下列活动属于实施绿色化学活动的是: ( )
A.处理废弃物--烟灰、烟蒂 B.治理 污染点--通风、排除烟雾
C.减少有毒物--使用过滤嘴、低焦油烟 D.杜绝污染物--禁烟、戒烟
24、(9分)在一个固定体积的密闭容器中,保持一定温度,进行以下反应:
H2(g)+Br2(g)≒2HBr(g)
已知加入1molH2和2molBr2时,达到平衡后生成amolHBr(见下表“已知”项)。在相同条件下,且保持平衡时各组分的摩尔分数不变,对下列编号(1)~(3)的状态,填写表中的空白:
|
编号 |
起始状态(mol) |
平衡时HBr物质的量 (mol) |
||
|
H2 |
Br2 |
HBr |
||
|
已知 |
1 |
2 |
0 |
a |
|
⑴ |
2 |
4 |
0 |
|
|
⑵ |
|
|
1 |
0.5a |
|
⑶ |
m |
N(n≥2m) |
|
|
23、(8分)已知,向Zn2+离子溶液中滴加氨水,生成Zn(OH)2白色沉淀;但是氨水过量时,沉淀又溶解,生成了Zn(NH3)42+。此外,Zn(OH)2既可溶于盐酸,也可溶于过量NaOH溶液中,生成ZnO22-,所以Zn(OH)2是一种两性氢氧化物。
现有4组离子,每组有2种金属离子。请各选用1种试剂,将它们两者分开。可供选用的试剂有:A 硫酸 B 盐酸 C 硝酸 D 氢氧化钠溶液 E 氨水(填写时用字母代号)
请填写下表:
|
离子组 |
选用的试剂(代号) |
沉淀物的化学式 |
保留在溶液中的离子 |
|
⑴Zn2+和Al3+ |
|
|
|
|
⑵Zn2+和Mg2+ |
|
|
|
|
⑶Zn2+和Ba2+ |
|
|
|
|
⑷Fe3+和Al3+ |
|
|
|
22、(5分)某碳氢化合物A。是无色晶体,熔点为130~131℃。结构分析证实,在A的分子中:⑴有8个碳原子;⑵每个碳原子都以3个键长相等的单键分别跟其它3个碳原子相连。⑶只有一种碳-碳-碳-键角。请⑴写出化合物A的分子式;⑵判断分子中有没有烯键;⑶写出分子A的结构式(只要求写出碳的骨架,不需要写出C、H的元素符号)。
答:A的分子式是 ,分子中 烯键(填有或没有)。
A的结构式是:
21、(6分)A是一种可以作为药物的有机化合物。请从下列反应图式中各有机化合物的关系(所有无机产物无已略去未写),推测有机化合物A、B、C、E、F的结构简式。(Ф代表苯基)
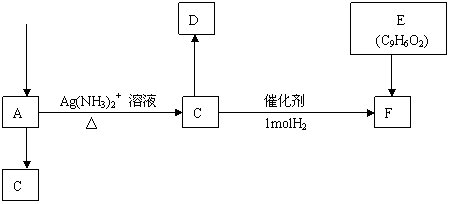 ФCHO
NaOH,乙醇溶液
ФCHO
NaOH,乙醇溶液
 CH3CHO
CH3CHO
NaOH溶液,△,去水 Br2-CCl4溶液
2molH2 催化剂
2molH2,
催化剂
答:A是 ;B是 ;C是 ;E是 ;F是 。
20、(6分)吗啡和海洛因都是严格查禁的毒品。吗啡分子含C 71.58%、H 6.67%、N 4.91%、其余为O。已知其分子量不超过300。试求:⑴吗啡的分子量;⑵吗啡的分子式。
已知海洛因是吗啡的二乙酸酯。试求:⑴海洛因的分子量;⑵海洛因的分子式。
答:吗啡的分子量是 、分子式是 。
海洛因的分子量是 ,分子式是 。
15.1gNa2SO3现取溶于80.0mL水。另取5.00g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中。用小火加热至微沸,反应约1h后过滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体。
⑴若加入的硫粉不用乙醇润湿,对反应的影响是 。(填写选项的字母,可以多选,但选错要倒扣。)
A 会降低反应速率 B需要提高反应温度 C将增大反应体系的pH值 D会减少产量
⑵反应1h后过滤,其目的是 。
⑶滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。它是由 而产生的。如果滤液中该杂质的含量不很低,其检测的方法是: 。
⑷设Na2SO3跟硫粉完全反应,当交将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明。(70℃时,Na2S2O3饱和溶液的密度为1.17g/cm3)
⑸若要计算在100℃下将溶液蒸发至体积为30.0mL,再冷却至10℃时所能得到的Na2SO3·5H2O的质量,你认为 。(填写一个选项的字母)
A 前面提供的数据已经足够。 B还需要提供100℃时溶液的密度(1.14g/cm3)。 C还需要提供结晶后剩余溶液的体积(10.0mL)。
⑹根据第(5)小题你的选择(如选(A)则直接计算,如选(B)或(C)则可选用其数据),计算从10℃、30.0mL溶液中结晶而出的Na2S2O3·5H2O的质量。
19、(17分)用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。Na2S2O3在酸性溶液中立即完全分解:Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl
18、(12分)已知乙醇可以和氯化钙反应生成微溶于水的CaCl2·6C2H5OH。有关的有机试剂的沸点如下:CH3COOC2H5 77.1℃ C2H5OC2H5(乙醚) 34.5℃ C2H5OH 78.3℃ CH3COOH 118℃ 实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇与少量浓硫酸混合,然后经分液漏斗边滴加醋、边加热蒸馏。得到含有乙醇、乙醚、醋酸和水的乙酸乙酯粗产品。
⑴反应中加入乙醇是过量的,其目的是: 。
⑵边滴加醋酸、边加热蒸馏的目的是: 。
将粗产品再经下列步骤精制:
⑶为除运河其中的醋酸,可向产品中加入(填字母)。A 无水乙醇 B 碳酸钠粉末 C 无水醋酸钠
⑷再向其中加入饱和氯化钙溶液,振荡。其目的是: 。
⑸然后再向其中加入无水硫酸钠,振荡。其目的是: 。
最后,将经过上述处理后的液体放入另一干燥的蒸馏瓶内,再蒸馏。弃去低沸点馏分,收集76~78℃沸程之间的馏分即得。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com