
题目列表(包括答案和解析)
26.为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式 。
(2)甲同学设计的实验 (填能或不能)验证乙炔与澳发生加成反应,其理由是 (多选扣分)。
(a)使溴水褪色的反应,未必是加成反应
(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔
(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的化学方程式是 ;在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
(a) (b) (c) (d)
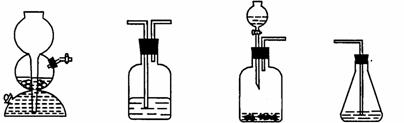
→ b → → d
(电石、水)( ) ( ) (溴水)
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是 。
25.致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒,就是易燃、于是科学家根据元素性质的递变规律来开发新的致冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期 > >H2O、HF;
第三周期 SiH4>PH3> > 。
(2)化合物的毒性:PH3>NH3 H2S H2O;
CS2 CO2 CCl4 CF4 (选填>或<=。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了,其它类似的还可以是 。
(4)然而,这种致冷剂造成了当今的某一环境问题是 。
但求助于周期表中元素及其化合物的 变化趋势来开发致冷剂的科学思维方法是值得借鉴的。(填写字母,多选扣分)
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
(a)①②③ (b)②④⑤ (c)②③④
24.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
(a)容器中压强不变 (b)混合气体中 c(CO)不变
(c)v正(H2)=v逆(H2O) (d)c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
23.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):
KCN+2KOH+Cl2 → KOCN+2KCl+H2O
被氧化的元素是 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
KOCN+ KOH+ Cl2 → CO2 + N2 + KCl + H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
22.0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是
A 30 B 46 C 50 D 66
中学综合整理编辑
第Ⅱ卷(共84分)
21.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是
A 向CuSO4溶液中加入适量铁粉
B 等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C 等物质的量的NaHCO3与Na2O2固体
D 在NaBr溶液中通入过量氯气
20.在常温下10mL pH=10的KOH溶液中,加人pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A c(A-)=c(K+) B c(H+)=c(OH-)<c(K+)<c(A-)
C V总≥20mL D V总≤20mL
19.下列离子方程式书写正确的是
A FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl-
B 澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-→CaCO3↓+H2O
C FeS固体放人稀硝酸溶液中:FeS+2H+→Fe2++H2S↑
D AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O
18.在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.01mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A 中和时所需NaOH的量 B 电离度
C 对的物质的量 D CH3COOH的物质的量
17.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是
A 化学不再是纯实验科学 B 化学不再需要实验
C 化学不做实验,就什么都不知道 D 未来化学的方向还是经验化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com