
题目列表(包括答案和解析)
25.(1+2+1+1+1+3=9分)某同学用50mL NaOH溶液吸收CO2气体制备Na2CO3.为防止通入的CO2过量而生成NaHCO3,他设计了如下步骤:(i)用25mL NaOH溶液吸收过量的CO2气体至CO2气体不再溶解;(ii)小心煮沸溶液1~2分钟;(iii)在得到的溶液中加入另一半(25mL)NaOH溶液,使溶液充分混合。
(1)他能否制得较纯净的Na2CO3 ,理由是 。
(2)按他的设计,第(i)步实验装置如图
①装置A使用的试剂是石灰石和盐酸.可否使用纯碱代替石灰石 。
②装置B使用的试剂的作用是 。
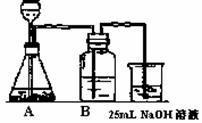 ③为了后续的煮沸、混合等实验,装NaOH溶液的容器还可使用
(填实验仪器).
③为了后续的煮沸、混合等实验,装NaOH溶液的容器还可使用
(填实验仪器).
④有人认为实验步骤(ii)、(iii)的顺序对调,即先混合再煮沸更合理,你认为对吗?为什么?
答案:25.(1)能;实验①生成NaHCO3,其中过量溶解的CO2气体煮沸时除去,在实验③NaHCO3恰好NaOH中和完全转化为Na2CO3(2)①不能(实验中使用的CO2气体发生器,只适用于块状固体和液体反应,Na2CO3是粉末状固体).②除去HCl.③锥形瓶.④不合理;若不先驱出溶液中溶解的CO2气体,实验③加入的NaOH将有一部分消耗于与CO2的反应,使NaHCO3不能完全转化为Na2CO3.
24.(1+1+2+5+1+1+1=12分)实验室配制500 mL0.1 mol/L Na2CO3溶液回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体____ g。(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g (1 g以下用游码)。(3)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为_______(同一步骤可用多次)。
A.调整零点;B.将游码移至刻度尺的零刻度处;C.将碳酸钠晶体放入小烧杯中称量;
D.称量空的小烧杯;E.将砝码放回砝码盒内;F.记录称量结果。
(4)配制Na2CO3溶液时需用的主要仪器有_____________ _______。
(5)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变? A.加水时越过刻度线_________。B.忘记将洗涤液加入容量瓶__________。C.定容后摇匀液面低于刻度线______________。
答案:24、(1)14.3克 (2)13.7克 (3)BADFCFE
(4)烧杯、托盘天平、玻璃棒、容量瓶、胶头滴管。 (5)低、低、无。
23.(8分)有1、2、3、4号4瓶未知溶液,它们是NaCl (0.1 mol/L)、HCl (0.1 mol/L)、NaOH (0.1 mol/L)和酚酞(0.1%)。某同学不用其他试剂,就把它们一一鉴别开来了,其实验步骤如下:
⑴各取溶液少许两两混合,据此分成两组。⑵取一组混合液,不断滴入另一组的一种未知溶液,据此可鉴别出1号和2号。⑶再取已鉴别出的1号2mL,滴入3滴3号未知液,再加入4号未知溶液4mL,在这个过程中无明显实验现象。综合以上实验,可以确定:
1号是 ,2号是 ,3号是 ,4号是 。
答案:23.1号是 盐酸溶液 ,2号是氯化钠溶液,3号是烧碱溶液,4号是 酚酞试液。
22.(6分)多硫化物Sx2– (X的数值在2~6之间)在碱性溶液中被BrO3–氧化为SO42–,而BrO3–被还原为Br-,在反应中消耗BrO3–和OH-的物质的量之比为2 : 3,则
(1) X的值为 ;(2) 反应的离子方程式 ;
(3) 此反应的还原剂与氧化剂物质的量之比是 。
答案:22. 5 3S25-+16BrO3-+24OH-=15SO42-+16Br-+12H2O 3:16
21.(8分)实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI + Hg→Cu2HgI4 + 2Cu
(1) 上述反应产物Cu2HgI4中,Cu元素显 价。
(2) 以上反应中的氧化剂为 ,当有1molCuI参与反应时,转移电子 mol。
(3) CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:
Cu2+ + I- - CuI + I3-
答案:21.(1)+1 (2)CuI 0.5 (3)2 5 2 1
20、(6分)将ag金属钠投入到bg水中(足量)。
(1)所得溶液中溶质的质量分数为 。
(2)能否求溶液物质的量浓度?为什么?__________ _ ___________ 。(3)所得溶液中Na+与的H2O个数比为 。
答案:20、(1)40a/(22a+23b)×100%。(2)不可以,因缺少溶液的密度。(3)18a/(23b-18a)。
19、(6分)在天平的两个托盘上各放一盛有等体积稀硫酸的烧杯(每杯溶液中都含有m mol的H2SO4),调节天平使其平衡。然后在一个烧杯中加入a g铁粉,在另一个烧杯中加入b g镁粉,充分反应后,天平仍平衡。试用代数式表示下列情况下a与b的关系(关系式中可含m):
(1)若a/56>m,b/24>m ;(2)若a/56<m,b/24<m ;
(3)若a/56<m,b/24>m 。
答案:19、(1)a=b (2)27a/28=11b/12 (3)27a/28=b–2m
18.某结晶水合物化学式为R·nH2O,其式量为M。 25℃时,将a g该晶体溶于b g H2O中恰好形成V ml饱和溶液。下列表示式正确的是:BC
A.饱和溶液物质的量浓度为: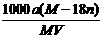 mol·L-1
mol·L-1
B.饱和溶液溶质的质量分数为: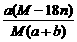 x 100%
x 100%
C.25℃时R的溶解度为: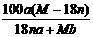 g
g
D.饱和溶液的密度为: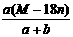 g/mL
g/mL
第II卷(非选择题部分,共78分)
17.有Na2CO3、NaHCO3、CaO和NaOH组成的混合物13.6克,把它们溶于足量的水中,充分反应后,溶液中的Ca2+、CO32-和HCO3-均转化为沉淀,将反应容器中的水分蒸干,最后得到白色固体共14.5克,则原混合物中Na2CO3的质量为:B
A.10.6克 B.5.3克 C.5.9克 D.无法确定
16.将一小块焦炭和x g O2同时放入装有压力表的密闭容器中,压强为P0。当在一定条件下充分反应后恢复到原温度,压强为P1,且P0<P1<2P0,则加入焦炭的质量m为:D
A.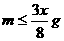 B.
B. C.
C.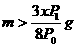 D.
D.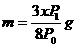
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com