
题目列表(包括答案和解析)
24、某溶液中可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种。(1)在该溶液中滴加足量氯水后,有气泡产生、溶液呈橙黄色;(2)向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;(3)橙黄色溶液不能使淀粉溶液变蓝。根据上述实验事实推断,在该溶液中肯定都存在的离子组是:A、Na+、Br-、CO32-; B、Na+、SO32-、I-;C、Fe2+、I-、SO32-;D、Fe2+、CO32-、Br-。
23、室温下,有下列四种溶液:①0.1mol·L-1NH3·H2O;②0.1mol·L-1NH4Cl;③0.2mol·L-1盐酸与0.2mol·L-1NH4Cl等体积混合;④0.2mol·L-1NaOH与0.2mol·L-1NH3·H2O等体积混合。其中c(NH4+)由大到小的顺序是:
A、②>③>④>①;B、③>②>①>④;C、①>④>②>③;D、④>①>②>③。
22、下列事实不能用勒沙特列原理解释的是:
A. 在硫酸亚铁溶液中,加入铁粉以防止氧化;B.实验室常用排饱和食盐水的方法收集氯气;
C. 生产硝酸的过程中使用过量空气以提高氨气的利用率;D. 氨水应密闭保存,放置低温处。
21、下列实验操作错误的是:
A.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口;B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出;C.配制浓硫酸与浓硝酸的混酸时,应将浓硫酸慢慢加到浓硝酸中,并及时搅拌和冷却;D.欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较。
20、一定条件下,可逆反应X(g)+3Y(g)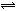 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断不合理的是:A、c1:c2=1:3;B、平衡时,Y与Z的生成速率之比为3:2;
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断不合理的是:A、c1:c2=1:3;B、平衡时,Y与Z的生成速率之比为3:2;
C、X、Y的转化率不相等;D、c1的取值范围为0<c1<0.14mol·L-1。
19、为了区别5瓶无色溶液:HCl、AlCl3、Ba(NO3)2、NaCl、Na2CO3,甲、乙、丙、丁4位
学生都没有酒精灯,其中1位学生没有另用任何试剂。他们中操作步骤一定最少的是:
A、甲另用了pH试纸;B、乙另用了NaOH溶液;C、丙另用了石蕊试液;D、丁不用任何试剂。
18、下列离子方程式正确的是:
A、用惰性电极电解MgCl2溶液:2Cl-+2H2O=(电解)Cl2↑+H2↑+2OH-
B、Fe2O3溶液于HI溶液中:Fe2O3+6H+=2Fe3++3H2O
C、向NaHCO3溶液中加入过量的Ca(OH)2溶液:Ca2++2HCO3-+2OH-=CO32-+CaCO3↓+2H2O
D、SO2气体通入溴水:SO2+Br2+2H2O=4H++SO42-+2Br-。
17、某工广排放的酸性废水中含有较多量的Cu2+,它对农作物和人畜都有害,欲采用化学方法
去掉有害成分,最好加入下列的物质是:
A.食盐和硫酸; B.胆矾和石灰水;C.铁粉和生石灰;D.苏打和硫酸。
16、下列试剂能鉴别盐酸、石灰水和氯化钙三瓶无色溶液的是:
①AgNO3溶液;②Na2CO3溶液;③NaHCO3溶液;④酚酞试液。
A、只有①;B、只有④;C、②或④;D、③或④。
15、单质钛的机械强度高,抗腐蚀能力强,有未来金属之称,工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取金属钛,主要反应有:(1)FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O;(2)Ti(SO4)2 +3H2O= H2TiO3+2H2SO4;(3)H2TiO3=TiO2+H2O;(4)TiO2+2C+2Cl2=TiCl4+2CO;(5)TiCl4+2Mg=2MgCl2+Ti。下列叙述中,错误的是:A、反应(1)是非氧化还原反应;B、反应(2)是水解反应;C、反应(4)中TiO2是氧化剂;D、反应(5)表现了金属镁的还原性比金属钛强。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com