
题目列表(包括答案和解析)
3.某地区的地表层存在大量KNO3、Na2SO4·10H2O等矿物,你认为该地区的气候特点是
A.干旱 B.多雨 C.旱季雨季分明 D.洪涝
2.在实验室里可按右图的装置干燥、收集气体R,多余的气体可用水吸收,则R是
A.HCl B.Cl2 C.NO2 D.NH3
1.用NA表示阿佛加德罗常数,下列说法不正确的是
A.标准状态下的辛烷22.4L完全燃烧产生CO2分子数为8NA
 B.18g水中所含电子个数为10
NA
B.18g水中所含电子个数为10
NA
C.46gNO2和46gN2O4中所含原子数均为3 NA
D.1L2mol·L-1的Mg(NO3)2溶液中含NO-3个数为4 NA
21、一定温度下的质量分数为16.7%的饱和硫酸铜溶液。取一定量此溶液进行电解,当阴极析出的金属质量不在增加时,立即停止通电。此时在阳极收集到气体5.6 L(标况),并得到无色溶液。此时测得溶液的密度为1.074 g/cm3。试求:
(1)该温度下,硫酸铜的溶解度。
(2)电解后所得溶液的质量分数和物质的量浓度。
(3)取1%的电解后的溶液稀释到1 L,求稀释后溶液的pH值。
20、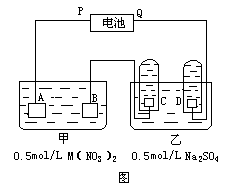 下图是两种溶液进行电解的装置。电极A是由金属M制成的,M的硝酸盐的化学式为M(NO3)2,B,C,D都是铂电极,P,Q是电池的两极,电路接通后,电极B上金属M沉淀出来:电极反应为____ __,同时电极C产生______,电极反应为__ ____,电极D产生______,电极反应为__
____。
下图是两种溶液进行电解的装置。电极A是由金属M制成的,M的硝酸盐的化学式为M(NO3)2,B,C,D都是铂电极,P,Q是电池的两极,电路接通后,电极B上金属M沉淀出来:电极反应为____ __,同时电极C产生______,电极反应为__ ____,电极D产生______,电极反应为__
____。
(1)电池中P是______极,Q是______极。
(2)A极上电极反应为___ ___。
(3)当电路中通过2.408×1022个电子时,
B极上沉淀出1.27gM,则M的计算式为______。
(4)如果将电池的正负极交换,接入原电路通过1.204×1022个电子时,看到B极上______.电极反应为___ ___,A极上析出______ g ______,电极反应为___ ___(假设M为Cu)。
19、有一瓶澄清的无色溶液,其中可能含有Na+、Ba2+、Cu2+、SO42-、Cl-、Br-、CO32-中的某几种,取该溶液进行下列实验:
①取部分溶液加足量稀硝酸,逸出气体;
②取上述逸出气体后的部分剩余溶液,加入足量氯水和四氯化碳,振荡后分层,四氯化碳层呈棕红色;
③取①实验后的部分剩余溶液,加入CaCl2溶液,可见白色浑浊;
④取②实验后的水层部分溶液,加入AgNO3溶液,稀HNO3溶液,有白色沉淀产生。
试回答:(1)原溶液中肯定存在的阴离子是______________________。
(2)肯定不存在的阳离子是_____________,理由是__________________。
(3)不能肯定存在与否的离子是___________,理由是_________________。
(4)写出实验的第①②③步发生及应的离子方程式:第①步:____________________;
第②步:________________________;第③步:___________________________。
18.甲是刚浸过硫酸钠溶液的滤纸,A、B两铜片通过导线连接电源两极,在铜片间的滤纸上滴一滴高锰酸钾溶液。通过一段时间后,发现A、B间的紫红色的圆点向A极移动了一段距离,则于A相连的是电源的______极,可以发现在滤纸上的_______极边缘附近有_______色出现。

17.(1)自来水厂用绿矾和氯气一起净水,写出有关反应的离子的方程式:①
② ③ 。
 (2)近几年来,某些自来水厂在用 液氯进行消毒处理时,还加入少量液氨,其作用是可以延长液氯杀菌的时间,反应的化学方程式为:
(2)近几年来,某些自来水厂在用 液氯进行消毒处理时,还加入少量液氨,其作用是可以延长液氯杀菌的时间,反应的化学方程式为:
NH3+HClO H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定。试分析液氨可以延长杀菌时间的原因 。
16、(将NaBiO3固体(黄色,微溶)加MnSO4和H2SO4的混合液里加热,溶液显紫色(Bi3+无色),配平该反应的离子方程式:
□NaBiO3 + □Mn2+ + □H+ š □Na+ + □Bi3+ + □__ + □__
15、下列各组离子,在指定的环境中一定能大量共存的是 ( )
A、pH=7的溶液中:Al3+ 、K+ 、SO42-、HCO3-
B、能使pH试纸变深蓝色的溶液中:S2-、SO32-、S2O32-、SO42-
C、加入铝粉放出H2的溶液中:CO32-、AlO2-、I-、NO3-
D、由水电离出c(OH- )=1×10-3mol·L-1的溶液中:Fe2+、NH4+、Cl-、、SO42-
班级 姓名 学号
卷II
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com