
题目列表(包括答案和解析)
19.实验室将Na2SO3和NaClO3按分子个数1:2倒入烧杯中,同时加入适量硫酸,并用水
浴加热,产生棕黄色气体X,反应后测得Na2SO3和NaClO3恰好完全反应,则X为( )
A.Cl2 B.Cl2O C.Cl2O2 D. ClO2
17.用特殊的方法把固体物质加工纳米级(1nm=1×10-9m)的超细粉末粒子,由这些超细粉
末制得的材料叫纳米材料。某分散系中分散质的微粒直径位20nm,那么该分散系不可
能 ( )
A.产生丁达尔现象 B.加入电解质后发生凝聚
C.通过滤纸 D.通过半透膜
 18.根据离子晶体的晶体结构,判断错误的化学式是 ( )
18.根据离子晶体的晶体结构,判断错误的化学式是 ( )
A.② B.① C.③ D.④
16.恒容下的2SO2+O2 2SO3+Q,达到平衡后,下列可以加快反应速率的方法是( )
A.将SO3分离出一部分 B. 升温
C.充入少量N2,增大压强 D.充入少量SO3气体
15.下列各选项所述的两个量,前者一定大于后者的是 ( )
①F2和Br2的沸点
②纯水在25℃和80℃时的PH值
③同温下分别在100g水中最多能溶解的无水CuSO5和CuSO5·5H2O的质量
④25℃时,等体积的PH值都等于3的盐酸和AlCl3溶液中,已电离的水分子数
⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数
⑥耐火材料MgO和CaO的熔点
⑦H-和H+离子半径
⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
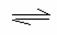 A.①②⑥ B.①②③⑤ C.②⑦⑥ D.⑤⑥⑦
A.①②⑥ B.①②③⑤ C.②⑦⑥ D.⑤⑥⑦
13.下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作
一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确
 的是 ( )
的是 ( )
A.溶液的pH变化:①减小②增大
B.电极上析出固体质量①<②
C.电极反应式:①中阳极:4OH---4e-=2H2O+O2↑②中负极2H++2e-=H2↑
D.产生气体体积①=②
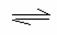 14.恒温恒压下,在容积可变的容器中,反应2NO2(g)
N2O4 (g)达到平衡后,再
14.恒温恒压下,在容积可变的容器中,反应2NO2(g)
N2O4 (g)达到平衡后,再
向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数 ( )
A.不变 B.减小 C.增大 D.无法判断
12.下列各组中的离子能在同一溶液中大量共存,用足量盐酸酸化后,溶液仍然澄清透明且
颜色无变化的是 ( )
A.K+ Ba2+ HCO NO
NO B. Mg2+ NO
B. Mg2+ NO SO
SO Fe2+
Fe2+
C.Na+ Ca2+ Cl- HPO D.Na+ K+ OH-
AlO
D.Na+ K+ OH-
AlO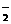
11.将甲、乙两种非金属的性质相比较,知道
①甲比乙容易与H2化合;
②甲原子能与乙的阴离子发生氧化还原反应;
③甲的最高价氧化物的水化酸性比乙的最高价氧化物的水化物酸性强;
④与某金属反应时甲原子得电子数目比乙的多;
⑤甲的单质熔、沸点比乙低。
能说明甲比乙的非金属性强的是 ( )
A.①④ B.③⑤ C.①②③④⑤ D.①②③
10.设NA代表阿佛加德罗常数,下列说法中正确的是 ( )
①常温常压下,17g甲基(-14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol/L 的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标况时,22.4L二氯甲烷所含有的分子数为4NA
⑥常温常压下,1mol氦气含有的核外电子数为4NA
A.①② B.②④ C.③④ D.⑤⑥
9.下列反应的离子方程式正确的是 ( )
A.少量SO2气体通入NaClO溶液中
SO2+H2O+ClO-=2HClO+ SO
B.亚硫酸氢铵溶液与等物质量的氢氧化钠溶液混合
NH +HSO
+HSO +2OH-=SO
+2OH-=SO +NH3+2H2O
+NH3+2H2O
C.Fe2O3溶于过量的氢碘酸中
Fe2O3+6H+=2Fe3++3H2O
D.向磷酸氢二钠溶液中加入过量澄清石灰水
2HPO +3Ca2++2OH-=Ca3(PO4)2↓+2H2O
+3Ca2++2OH-=Ca3(PO4)2↓+2H2O
8.下列溶液中的各组离子,因发生氧化还原反应而不能大量共存的是 ( )
A.AlO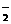 、OH-、Na+、NH
、OH-、Na+、NH B.H+、Na+、NO
B.H+、Na+、NO 、SO
、SO
C.Fe3+、SCN-、SO 、Cl- D.Fe3+、HCO
、Cl- D.Fe3+、HCO 、Cl-、NH
、Cl-、NH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com