
题目列表(包括答案和解析)
1.通过钠的化学性质的学习,能正确分析钠长久露置于空气中发生的一系列变化的现象和原 理.
3.碳酸钠和碳酸氢钠的性质和制法:
|
名称和化学式 |
碳酸钠(Na2CO3) |
碳酸氢钠(NaHCO3) |
|
俗名 |
纯碱、苏打 |
小苏打 |
|
颜色和状态 |
白色晶体 |
白色粉末 |
|
水中溶解性 |
易溶 |
易溶(比Na2CO3小) |
|
热稳定性 |
稳定 |
不稳定 2NaHCO3 Na2CO3+CO2  +H2O +H2O |
|
与酸反应 |
CO2-3+H+ HCO-3 HCO-3HCO-3+H+  H2O+CO2 H2O+CO2 |
HCO-3+H+ CO2 CO2 +H2O +H2O |
|
与某些碱反应 |
Ca(OH)2+Na2CO3 CaCO3 CaCO3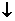 +2 +2NaOH |
NaHCO3+Ca(OH)2 CaCO3 CaCO3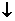 +NaOH+H2O 2NaHCO3+Ca(OH)2  CaCO3 CaCO3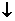 +Na2CO3+2H2O +Na2CO3+2H2O |
|
与某些盐反应 |
BaCl2+Na2CO3 BaCO3 BaCO3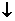 +2NaCl +2NaCl |
NaHCO3+NaHSO4 Na2SO4+ Na2SO4+H2O+CO2  |
|
与CO2反应 |
Na2CO3+CO2+H2O 2NaHCO3 2NaHCO3 |
不反应 |
|
相互转化 |
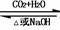 Na2CO3 NaHCO3 Na2CO3 NaHCO3
|
|
|
制法 |
NaOH+CO2 NaHCO3 NaHCO32NaHCO3  2Na2CO3+H2O+CO2 2Na2CO3+H2O+CO2 |
NaOH+CO2 NaHCO3 NaHCO3 |
|
鉴别 |
加酸产生CO2加热难分解 |
加酸产生CO2较Na2CO3快加热分解出CO2 |
|
用途 |
制玻璃、肥皂、造纸、纺织 |
发酵粉、治胃酸过多 |
2.钠的氧化物和氢氧化物的性质和制法:
|
名称和化学式 |
氧化钠(Na2O) |
过氧化钠(Na2O2) |
氢氧化钠(NaOH) |
|
颜色和状态 |
白色固体 |
淡黄色固体 |
无色固体 |
|
类别 |
碱性氧化物 离子化合物 |
过氧化物 离子化合物 |
碱 离子化合物 |
|
电子式 |
Na+[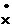  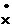 ]Na+ ]Na+ |
Na+[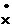  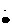  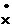 ]2-Na+ ]2-Na+ |
Na+[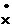  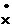 H]- H]- |
|
氧元素化合价 |
-2 |
-1 |
-2 |
|
化学键 |
离子键 |
离子键 非极性键 |
离子键 极性键 |
|
稳定性 |
不稳定 |
比Na2O稳定 |
离子键 极性键 |
|
与水反应 |
Na2O+H2O 2NaOH 2NaOH |
2Na2O2+2H2O 4NaOH+ 4NaOH+O2  |
不反应 |
|
与酸反应 |
Na2O+2HCl 2NaCl 2NaCl+H2O |
2NaO2+4HCl 4NaCl 4NaCl+O2  +2H2O +2H2O |
NaOH+HCl NaCl NaCl+H2O |
|
与酸酐反应 |
Na2O+CO2 Na2CO3 Na2CO3 |
2Na2O2+2CO2 2Na2 2Na2CO3+O2  |
2NaOH+CO2 Na2CO3 Na2CO3+H2O NaOH+CO2  NaHCO3 NaHCO3 |
|
与盐溶液反应 |
Na2O+2NaHSO4 2N 2NaSO4+H2O Na2O+H2O+CuSO4  Cu(OH)2  +Na2SO4 +Na2SO4 |
2Na2O2+4NaHSO4 4 4Na2SO4+O2  +2H2O +2H2O2Na2O2+H2O+CuSO4  Cu(OH)2  +2Na2SO4+O2 +2Na2SO4+O2 |
NaOH+NaHSO4 Na2 Na2SO4+H2O 2NaOH+CuSO4  Cu( Cu(OH)2  +Na2SO4 +Na2SO4 |
|
制法 |
2Na+Na2O2 2Na2O 2Na2O6Na+2NaNO2  N2 N2 +4Na2O +4Na2O |
2Na+O2 Na2O2 Na2O2 |
Na2O+H2O 2NaOH 2NaOH2NaCl+2H2O  2NaOH+ 2NaOH+Cl2  +H2 +H2 |
|
用途 |
制氢氧化钠 |
漂白剂、供氧剂、氧化剂 |
化工原料、制纸浆、肥皂 |
1.碱金属元素原子结构、单质性质、制法:
|
名称和符号 |
锂(Li) |
钠(Na) |
钾(K) |
铷(Rb) |
铯Cs |
||
|
结 构 |
原子序数 |
3 |
11 |
19 |
37 |
55 |
|
|
原子结构简图 |
 |
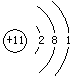 |
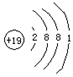 |
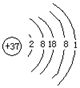 |
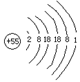 |
||
|
电子式 |
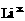 |
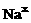 |
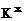 |
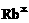 |
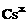 |
||
|
主要化合价 |
+1 |
+1 |
+1 |
+1 |
+1 |
||
|
相同点 |
最外层电子数相同,都是1个电子 |
||||||
|
不同点 |
原子核外电子层不同,依次增多 |
||||||
|
原子半径 |
依次递增 |
||||||
|
离子半径 |
依次递增 |
||||||
|
金属活动性 |
依次递增 |
||||||
|
单质还原性 |
依次递增 |
||||||
|
阳离子氧化性 |
依次递减 |
||||||
|
物理性质 |
颜色和状态 |
银白色固体 |
|||||
|
密度 |
0.534/cm3 |
1.97/cm3 |
0.86g/cm3 |
1.532g/cm3 |
1.879g/cm3 |
||
|
熔点 |
依次递减 |
||||||
|
沸点 |
依次递减 |
||||||
|
化学性 质 |
跟氧气反应 |
2Li+O2 2LiO |
4Na+O2 2Na2O 2Na+O2  Na2O2 |
2K+O2 K2O2 K+O2  KO2 |
Rb+O2 RbO2 |
Cs+O2 CsO2 |
|
|
跟卤素反应 |
2M+X2 2MX(M、X2表示碱金属、卤素) 2MX(M、X2表示碱金属、卤素) |
||||||
|
跟硫反应 |
2M+S M2S M2S |
||||||
|
与水反应 |
2M+2H2O 2MOH+H2 2MOH+H2 反应剧烈程度:Li<Na<K<Rb<Cs 反应剧烈程度:Li<Na<K<Rb<Cs |
||||||
|
与酸反应 |
2M+2H+ 2M++H2 2M++H2 |
||||||
|
与盐溶液反应如(CuSO4) |
2M+2H2O+CuSO4 M2SO4+Cu(OH)2 M2SO4+Cu(OH)2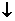 +H2 +H2 |
||||||
|
制法 |
 2MCl 2MCl 2M+Cl2 2M+Cl2 (K:Na+KCl 850℃ K+NaCl ) (K:Na+KCl 850℃ K+NaCl ) |
||||||
3.掌握碱金属的性质,理解碱金属原子结构与性质递变规律,掌握用焰色反应检验金属钠和 钾及其离子的操作技能.
2.掌握钠的氧化物的性质,钠的重要化合物的用途及Na2CO3与NaHCO3的联系与区别.
1.掌握钠的重要性质,了解钠的保存和重要用途.
32. (15分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
(15分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,两种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,两种溶质物质的量之比为 ;加盐酸后产生CO2体积最大值 mL。
(3)通过计算求出原NaOH溶液的物质的量浓度。
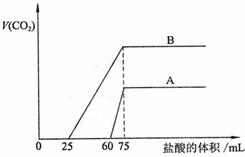
31. (20分)(Ⅰ)(10分)为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)。
(20分)(Ⅰ)(10分)为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)。
实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y。(如图)回答下面问题:
(1)在装置中试管和U型管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是 。
(2)液体X可能是 ;气体Y可能是 。
(3)导管口不再有气泡冒出时,停止反应,这时在操作上应注意 ,理由是 。
(4)用简单的实验证实(2)中的判断
①对X的判断 。
②对Y的判断(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论)
。
(Ⅱ)(10分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
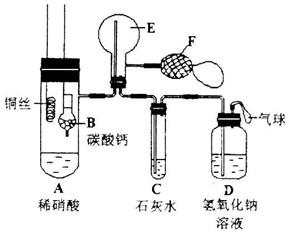
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为_______。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为_______________________________________________;
装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧并E内气体颜色加深,产生上述现象的原因是___________________________。
一段时间后,C中白色沉淀溶解,其原因是______________________。
(3)装置D的作用是________________________________________。
30.(15分)据下列信息完成所需回答的问题:
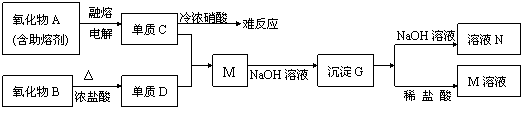
(1)A是 ,D是 ,G是 (填化学式)。
(2)元素C位于周期表中第 周期 族。
(3)写出下列反应的离子方程式:
B+浓盐酸 。
G+NaOH溶液 。
(4)单质C不与冷浓硝酸反应的原因是 。
(5)已知一定质量的B与足量的浓盐酸反应生成的D在标准状况下的体积为5.6L,求
被氧化的HCl的物质的量。(写出计算过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com