
题目列表(包括答案和解析)
24.(11分)准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20 mol/L NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
|
|
NaOH溶液起始读数 |
NaOH溶液终点读数 |
|
第一次 |
0.01Ml |
18.60mL |
|
第二次 |
0.20Ml |
18.00mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为______________mol/L。(精确到0.01)
(2)如标准NaOH溶液由于保存不妥而变质(和空气中 反应产生少量
反应产生少量 ),测出的盐酸浓度__________(填“偏高”、“偏低”或“不变”)。
),测出的盐酸浓度__________(填“偏高”、“偏低”或“不变”)。
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是____________(填序号)。
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?____________(填“是”或“否”)
23.(6分)右图所示装置是化学实验中常见的仪器,它除用于洗气处,还有其它用途:

(1)医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装盛有水的该装置,用于观察气泡产生的情况,以便调节供氧速率,此时氧气应从________(填标号,下同)管口导入。
(2)实验室用 与浓HCl反应制
与浓HCl反应制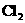 的实验中,在将生成的
的实验中,在将生成的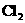 通入NaOH溶液之前,先将
通入NaOH溶液之前,先将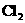 从该装置_________管口导进,从________管口导出。此时,该装置所起的作用是防止NaOH溶液倒流入反应器。
从该装置_________管口导进,从________管口导出。此时,该装置所起的作用是防止NaOH溶液倒流入反应器。
(3)当用此装置收集NO时,应采取的主要操作步骤是:
①______________________________________________________________;
②______________________________________________________________。
22.(15分)实验室中用浓盐酸与 反应制
反应制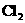 ,再用
,再用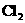 和
和 反应制少量漂白粉。已知
反应制少量漂白粉。已知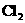 与
与 制漂白粉的反应是放热反应,温度稍高即发生副反应:6
制漂白粉的反应是放热反应,温度稍高即发生副反应:6 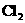 +6
+6 =
= +5Ca
+5Ca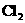 +6
+6 。现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过):
。现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过):

(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内。
a.不易控制反应速率 b.容易控制反应速率
c.有副反应发生 d.可防止副反应发生
e.容易污染环境 f.可防止污染环境
|
|
优点 |
缺点 |
|
甲装置 |
|
|
|
乙装置 |
|
|
|
丙装置 |
|
|
(2)请从甲、乙、丙三套装置中,选择合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,其连接顺序(按气流从左到右方向)为:_________;在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,并说明原因:______________________________________________________________________________________________________________________________________________________________________________________________。
21.某 样品中含有
样品中含有 、
、 和
和 三种杂质中的一种或两种,现将13.8g样品中加入足量水,样品全部溶解,再加入过量的
三种杂质中的一种或两种,现将13.8g样品中加入足量水,样品全部溶解,再加入过量的 溶液,得到9g沉淀。对样品所含杂质的正确判断是 ( )
溶液,得到9g沉淀。对样品所含杂质的正确判断是 ( )
A.肯定没有
B.肯定有 ,可能还有
,可能还有
C.肯定没有 ,可能有
,可能有
D.肯定没有 和
和
第Ⅱ卷(共77分)
20.在一容积不变的密闭容器中充入2 mol A和1 mol B发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后C的体积分数仍为W%,则x值为 ( )
xC(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后C的体积分数仍为W%,则x值为 ( )
A.只能为2 B.只能为3
C.可能是2,也可能是3 D.无法确定
19.有n mol金刚石中,含C-C非极性键数是 ( )
A.2n×6.02× B.n×6.02×
B.n×6.02×
C.4n×6.02× D.8n×6.02×
D.8n×6.02×
18.将氨水逐滴加入到稀盐酸中,使溶液为中性,则此时 ( )
A.c( )=c(
)=c( )
)
B.c( )>c(
)>c( )
)
C.c( )<c(
)<c( )
)
D.c( )与c(
)与c( )之间关系不确定
)之间关系不确定
17.物质的量浓度均为0.01mol/L的HA和BOH溶液,pH分别为3和12,将两溶液等体积混合后,所得溶液的pH ( )
A.≥7 B.一定>7 C.≤7 D.可能=7
16.臭氧可使湿润的淀粉碘化钾试纸变蓝,化学方程式为:
2KI+ +
+
 2KOH+
2KOH+ +
+
下列叙述正确的是 ( )
A. 在反应中被氧化成
在反应中被氧化成
B.该反应的还原产物是
C.1mol 在反应中得到2mol
在反应中得到2mol 
D.反应中氧化产物与还原产物物质的量之比为1∶2
15.航天技术上使用一种氢氧燃料电池,它具有高能轻便、不污染环境等优点,该电池总反应方程式为:2 +
+ =2
=2 ,该电池的正极反应可表示为( )
,该电池的正极反应可表示为( )
A. +4
+4
 2
2 ↑
B.
↑
B. +
+ +4
+4
 4
4
C.4 -4
-4

 ↑+2
↑+2 D.
D. -4
-4
 4
4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com