
题目列表(包括答案和解析)
5、将含NaCl杂质的NaOH样品5g,配成1200mL溶液,测得溶液的pH值为13,此样品的纯度为:A、80%;B、84%;C、94%;D、96%。
4、某元素的相对原子质量为59,在其氧化物中该元素的质量分数为71.08%,则它的化合价是:A、+1;B、+2;C、+3;D、+4。
3、0.1mol下列各物质溶于水,制成1L溶液,溶液的pH值由大到小排列正确的是:①NH4Cl;②K2O2;③NaHCO3;④C6H5ONa。A、①③④②;B、②④③①;C、③②④①;D、②③④①。
2、某硫酸溶液的物质的量浓度为Amol/L,质量分数为B%,则此硫酸溶液的密度为:
A、9.8B/A g/cm3;B、9.8A/B g/cm3;C、98B/A g/cm3;D、98A/B g/cm3。
1、下列叙述正确的是:A、物质的体积越大,所含的微粒数越多;B、1mol N2和1mol水只有在相同的气态状况下所含的分子数才相等;C、1mol的氦分子里含有2mol电子;D、质量相等的物质,若物质的量越多,则其摩尔质量就越大。
29.(10分)某化工厂每小时生产98%(质量分数)硫酸at,为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体含氧的体积分数为b%。该空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,通过计算回答下列问题。
(1)该厂每小时消耗标准状况下的空气的体积为_____________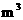 ;
;
(2)为了满足题设要求,b%的下限等于_____________。
高三基础知识检测(一)
28.(9分)血液中含葡萄糖(血糖)过高会引发糖尿病,低血糖,又会导致人易发生昏厥。正常人的血糖应为3.9mmo1/L-6.2mmol/L。某学生验血后得知其血糖的质量分数为0.1%。已知葡萄糖的相对分子质量为180,若血液的密度为1g/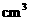 ,则该学生血液中血糖的物质的量浓度是否符合正常人的范围?(通过计算回答)
,则该学生血液中血糖的物质的量浓度是否符合正常人的范围?(通过计算回答)
[注:1mmol=1×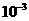 mol]
mol]
27.(10分)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
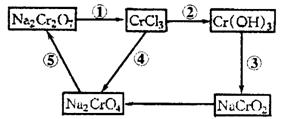
(1)在上述有编号的步骤中,需用还原剂的是______________,需用氧化剂的是_______________________(填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是___________(填化学式)。
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
□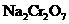 +□KI+□HCl-→□
+□KI+□HCl-→□ +□NaCl+□KCl+□
+□NaCl+□KCl+□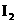 +□_________
+□_________
26.(6分)已知2NaCl+2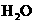
 2NaOH+
2NaOH+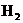 ↑+
↑+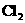 ↑,请画出一套能够实现反应Cu+2
↑,请画出一套能够实现反应Cu+2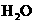
 Cu(OH)+
Cu(OH)+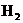 ↑的装置简图。(图中须标明所用化学药品是何种物质)
↑的装置简图。(图中须标明所用化学药品是何种物质)
25.(10分)A、B两种酸式含氧酸盐的相对分子质量均为120,且都溶于水;D、E均为无色气体:H是不溶于水和稀盐酸的白色沉淀。它们之间的转换关系如下图所示:
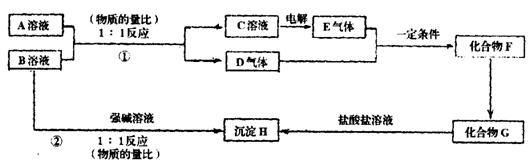
(1)A是___________,B是_____________(均写化学式)
(2)写出反应①和②的离子方程式
①___________________②________________________
(3)反应②发生后溶液的pH_______________7(填“>”、“<”或“=”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com