
题目列表(包括答案和解析)
5.硅及其重要化合物间的转化关系。

[同步达纲练习]
4.硅和硅的化合物的转变关系。
3.硅酸盐工业
①硅酸盐工业概念;
②制水泥的重要原料;
③制玻璃主要原料、主要反应,玻璃种类及用途。
2.硅和硅的化合物
1)组成和结构。
①硅的单质构成的晶体属于原子晶体,具有正四面体空间网状结构。与金钢石比较,性质相 似,又有差异。
②SiO2晶体是由硅原子和氧原子按1∶2比率组成,属于原子晶体。具有立体网状结构。
2)重要性质
物理性质
①Si、SiO2、H2SiO3、H4SiO4均难溶于水。
②Si、Ge是良好的半导体。
化学性质
硅的重要反应:
①Si+2F2 SiF4↑
SiF4↑
②Si+O2 SiO2
SiO2
二氧化硅的重要反应:
①SiO2+2SiC+2CO(制粗硅)
[SiCl4+2H2 Si+4HCl](制纯硅)
Si+4HCl](制纯硅)
②SiO2+CaO CaSiO3
CaSiO3
③SiO2+CaCO3 CaSiO3+CO2 (除脉石造渣)
CaSiO3+CO2 (除脉石造渣)
④SiO2+2NaOH Na2SiO3+H2O(腐蚀玻璃)
Na2SiO3+H2O(腐蚀玻璃)
⑤SiO2+4HF SiF4↑+2H2O(刻画玻璃)
SiF4↑+2H2O(刻画玻璃)
⑥SiO2+3C SiC+2CO↑(制金钢砂)
SiC+2CO↑(制金钢砂)
硅酸、硅酸钠的重要反应
Na2SiO3+2HCl H2SiO3↓+2NaCl
H2SiO3↓+2NaCl
Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3
H2SiO3↓+Na2CO3
H2SiO3 SiO2+H2O
SiO2+H2O
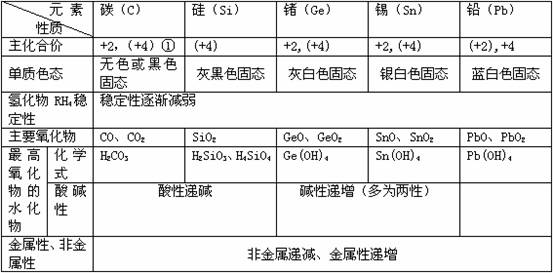
1.碳族元素的特点
1)碳族元素处于元素周期表的中间位置,获电子或失电子能力都较差,常温下,化学性质都不活泼。
2)碳族元素重要性质:
①化合价。在化合物中除硅表现+4价外,其余表现+2价和+4价。在与氢 形成化合物中,碳和硅表现-4价。②C、Si、Ge、Sn、Pb随核电荷数增加,原子半径逐渐增 大 ,非金属性逐渐减弱,金属性逐渐增强,其变化趋势比氮族元素更为明显。锗的金属性明显 地强于非金属性。③最高价氧化物的水化物的酸碱性随元素核电荷增加酸性减弱,碱性增强 。④气态氢化物的稳定性,随元素核电荷增加而逐渐减弱。⑤碳族元素正4价化合物比正二 价化合物稳定,但铅的正二价化合物比较稳定,如PbSO4.
2.碳的氧化物性质、结构比较。
|
碳的氧化物 |
CO |
CO2 |
|
|
电子式、结构式 |
-- |
: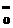 :: ::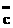 :: ::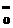 :o=c=o :o=c=o |
|
|
分子极性 |
极性分子 |
非极性分子 |
|
|
氧化物类型 |
不成盐氧化物 |
酸性氧化物 |
|
|
物理性质 |
无色气体难溶于水,有毒 |
无色气体,能溶于水,无毒 |
|
|
化 学 性 质 |
跟碱反应 |
一般不反应 |
典型酸酐、与碱反应 |
|
跟O2反应 |
可燃性2CO+O2 2CO2 2CO2 |
-- |
|
|
|
氧化-还原性 |
还原性:Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
氧化性但不强 C+CO2  2CO 2CO |
|
用途 |
气体燃料,还原剂 |
灭火剂、致冷剂、纯碱 |
1.碳族元素在周期表中位置、原子结构和性质。
3.了解水泥、玻璃的主要成分和简单生产原理。
2.认识硅及其重要化合物的性质和用途,初步了解硅和二氧化硅的晶体结构以及与性质的关 系。
1.掌握碳族元素的原子结构特点和性质递变规律。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com