
题目列表(包括答案和解析)
(二)通过分析、比较、综合、归纳掌握同分异构现象及其有关的知识内容。
在有机物中,经常出现由于分子中各原子的可能排列顺序和方式的变化,形成分子式虽然相同,但结构不同的化合物,而出现同分异构现象,这些具有同分异构现象的化合物互称为同分异构体。这就是有机物种类繁多的原因所在。同分异构体的概念中,有两个突出的要点:一是同分异构体间的共性,即“分子式相同”或是“分子组成相同”;另一是同分异构体间的差异,即“结构不同”且两个要点必须同时具备。现将一些存在“相同”和“相异”的概念比较如下:
|
|
相同点 |
不同点 |
|
同分异构体 |
分子式 |
结构 |
|
同系物 |
性质相似 |
分子组成中相差1个或n个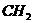 基 基 |
|
同位素 |
质子数 |
中子数 |
|
同素异形体 |
同种元素 |
不同单质 |
将同分异构体和同系物两概念相比较时,同分异构体概念中强调“分子式相同”,所以分子量必相等,而同系物强调分子组成上相差一个或几个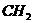 原子团,所以分子量必不等。因此,在互为同分异构体的各物质中,不可能存在互为同系物的物质,在互为同系物的各物质中,也不可能存在同分异构现象。
原子团,所以分子量必不等。因此,在互为同分异构体的各物质中,不可能存在互为同系物的物质,在互为同系物的各物质中,也不可能存在同分异构现象。
根据分子组成判断各同分异构体的结构和总数,是有机化学学习的重点内容之一。同分异构现象可分为3类。
(1)碳链异构(或称碳骨架异构):如乙苯和二甲苯,丁酸和异丁酸。
(2)相同官能团的位置异构:如1-丁烯和2-丁烯。
(3)官能团的种类异构:如丙醛和丙酮,乙醇和甲醚。
官能团的异构列表如下:
|
官能团异构类型 |
分子组成通式 |
|
烯烃-环烷烃 |
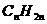 |
|
炔烃-二烯烃 |
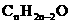 |
|
醇类-醚类 |
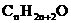 |
|
酚类-芳香醇-芳香醚 |
 |
|
醛类-酮类-烯醇类-环氧烷-环烷醇 |
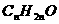 |
|
羰酸-酯类-羟基醛 |
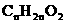 |
|
硝基化合物-氨基酸 |
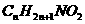 |
(一)根据结构掌握和运用各类有机化合物的分子组成通式。
学习有机化学的关键是认识有机化合物的结构,根据内在的物质结构去掌握有关的各种表象和问题。在掌握和运用各类有机物的分子组成通式时,也是如此。
分子中碳原子个数为n的链状烷烃的结构和其中碳、氢原子个数可表示如下:
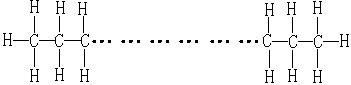
由此确定烷烃的分子组成通式为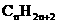 。而且当分子中碳原子个数为n个,其中氢原子个数的最大数为2n+2,是氢原子个数上限值。除了链状烷烃之外的各类有机物分子组成通式中,氢原子的个数都不大于此数值。若给出的有机物分子中,氢原子和碳原子的个数比大于
。而且当分子中碳原子个数为n个,其中氢原子个数的最大数为2n+2,是氢原子个数上限值。除了链状烷烃之外的各类有机物分子组成通式中,氢原子的个数都不大于此数值。若给出的有机物分子中,氢原子和碳原子的个数比大于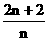 时,此分子组成肯定不正确。
时,此分子组成肯定不正确。
以链状烷烃分子结构和分子组成通式(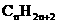 )为基础进行分析和比较:在结构中,若增加一个双键,就要少2个氢原子;若增加一个C≡C叁键,要少4个氢原子,在结构中出现一个环状结构,也要少2个氢原子。所以,烯烃和环烷烃的分子组成通式为
)为基础进行分析和比较:在结构中,若增加一个双键,就要少2个氢原子;若增加一个C≡C叁键,要少4个氢原子,在结构中出现一个环状结构,也要少2个氢原子。所以,烯烃和环烷烃的分子组成通式为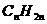 ,炔烃和二烯烃的分子组成通式为
,炔烃和二烯烃的分子组成通式为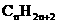 。苯和苯的同系物结构中有苯环结构,苯的结构用凯库勒式表示为,
。苯和苯的同系物结构中有苯环结构,苯的结构用凯库勒式表示为, 可看成是具有3个C=C双键和1个环状结构,分子中碳原子个数为n时,氢原子个数应是在2n+2的基础上减去2×4,得到苯和苯的同系物分子组成通式为
可看成是具有3个C=C双键和1个环状结构,分子中碳原子个数为n时,氢原子个数应是在2n+2的基础上减去2×4,得到苯和苯的同系物分子组成通式为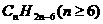 ,其他各类烃的分子组成通式,也可用同样的方法进行确定。
,其他各类烃的分子组成通式,也可用同样的方法进行确定。
烃的衍生物中,卤代烃是饱和链烃基和卤素相结合,根据卤代烃的结构,分子组成通式为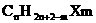 ,若其中的烃基不是烷烃基时,氢原子个数在此基础上,按前面所述根据不饱和键和环状结构的数量而减少,烃的含氧衍生物中,分子中碳原子个数为n个,每出现1个C=O时,也同样减少2个氢原子,单纯氧原子的个数多少,并不影响氢原子的个数,比如,1个碳原子与氢原子相连,或是与1个羟基相连,氢原子个数都是1。因此,在醇的分子组成通式中,饱和一元醇和醚是
,若其中的烃基不是烷烃基时,氢原子个数在此基础上,按前面所述根据不饱和键和环状结构的数量而减少,烃的含氧衍生物中,分子中碳原子个数为n个,每出现1个C=O时,也同样减少2个氢原子,单纯氧原子的个数多少,并不影响氢原子的个数,比如,1个碳原子与氢原子相连,或是与1个羟基相连,氢原子个数都是1。因此,在醇的分子组成通式中,饱和一元醇和醚是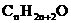 ,多元醇就是
,多元醇就是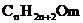 ,苯酚及其同系物、芳香醇是
,苯酚及其同系物、芳香醇是 ,醛、酮的分子结构中存在C=O键,分子组成通式为
,醛、酮的分子结构中存在C=O键,分子组成通式为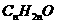 ,羰酸或酯就是
,羰酸或酯就是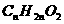 。若醛、酮、羰酸和酯的分子结构中烃基也出现碳碳不饱和键和环状结构时,仍要在原烃的衍生物分子组成通式中,相应减少一定个数的氢原子。如某醛分子式为
。若醛、酮、羰酸和酯的分子结构中烃基也出现碳碳不饱和键和环状结构时,仍要在原烃的衍生物分子组成通式中,相应减少一定个数的氢原子。如某醛分子式为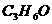 ,符合通式
,符合通式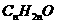 ,可确定为丙醛,分子组成为
,可确定为丙醛,分子组成为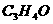 ,与
,与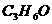 相比较少2个氢原子,可知
相比较少2个氢原子,可知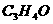 为丙烯醛,若将结构中的C=O键换成C=C双键时,分子式为
为丙烯醛,若将结构中的C=O键换成C=C双键时,分子式为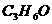 的有机物还可以是丙烯醇,从而可进一步确定:具有相同碳原子个数的醛、酮和烯醇互为同分异构体。
的有机物还可以是丙烯醇,从而可进一步确定:具有相同碳原子个数的醛、酮和烯醇互为同分异构体。
从上面的叙述和分析过程中,认识到:“分子结构是学好有机化学的关键”,对于“各类有机物的分子组成通式的掌握不应靠单纯的记忆,也不宜完全依赖数学中的单一数字指导推导,如苯的同系物看成由苯基和烷基结合而成,苯基为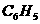 ;烷基设为
;烷基设为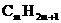 ,两者结合后化学式为
,两者结合后化学式为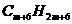 ,即
,即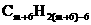 ,设m+6=n时,才最终得到苯和苯的同系物分子组成通式为
,设m+6=n时,才最终得到苯和苯的同系物分子组成通式为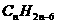 ,这一推导过程明显过于呆滞,不利于对各类有机物分子组成通式的掌握,也不便于应用。
,这一推导过程明显过于呆滞,不利于对各类有机物分子组成通式的掌握,也不便于应用。
6.酯化反应与中和反应的比较
|
|
酯化反应 |
中和反应 |
|
反应的过程 |
酸脱-OH醇去-H结合生成水 |
酸中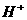 与碱中 与碱中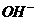 结合生成水 结合生成水 |
|
反应的实质 |
分子间反应 |
离子反应 |
|
反应的速率 |
缓慢 |
迅速 |
|
反应的程序 |
可逆反应 |
可进行彻底的反应 |
|
是否需要催化剂 |
需浓硫酸催化 |
不需要催化剂 |
5.烃的羰基衍生物性质比较
|
物质 |
结构简式 |
羰基稳定性 |
与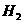 加成 加成 |
其它性质 |
|
乙醛 |
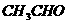 |
不稳定 |
容易 |
醛基中C-H键易被氧化(成酸) |
|
乙酸 |
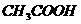 |
稳定 |
不易 |
羧基中C-O键易断裂(酯化) |
|
乙酸乙酯 |
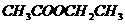 |
稳定 |
不易 |
酯链中C-O键易断裂(水解) |
4.烃的羟基衍生物性质比较
|
物质 |
结构简式 |
羟基中氢原子活泼性 |
酸性 |
与钠反应 |
与NaOH的反应 |
与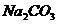 的反应 的反应 |
|
乙醇 苯酚 乙酸 |
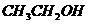 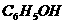 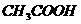 |
增 强 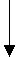 |
中性 |
能 |
不能 |
不能 |
比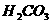 弱 弱 |
能 |
能 |
能 |
|||
强于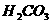 |
能 |
能 |
能 |
3.醛、羰酸、酯(油脂)的综合比较
|
通 式 |
醛 R-CHO |
羰酸 R-COOH |
酯 R-COOR' |
油脂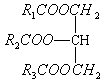 |
|
化学 性质 |
①加氢 ②银镜反应 ③催化氧化成酸 |
①酸性 ②酯化反应 ③脱羰反应 |
酸性条件 水解 碱性条件 |
水解 氢化(硬化、还原) |
|
代表物 |
甲醛、乙醛 |
甲酸 硬脂酸 乙酸 软脂酸 丙烯酸 油酸 |
硝酸乙酯 乙酸乙酯 |
硬脂酸甘油酯 油酸甘油酯 |
2.苯、甲苯、苯酚的分子结构及典型性质比较
|
类别 |
苯 |
甲苯 |
苯酚 |
|
|
结构简式 |
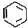 |
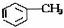 |
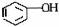 |
|
|
氧化反应 |
不被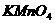 溶液氧化 溶液氧化 |
可被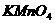 溶液氧化 溶液氧化 |
常温下在空气中被氧化呈红色 |
|
|
溴代反应 |
溴状态 |
液溴 |
液溴 |
溴水 |
|
条件 |
催化剂 |
催化剂 |
无催化剂 |
|
|
产物 |
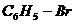 |
邻、间、对三种溴苯 |
三溴苯酚 |
|
|
结论 |
苯酚与溴的取代反应比苯、甲苯易进行 |
|||
|
原因 |
酚羟基对苯环的影响使苯环上的氢原子变得活泼、易被取代 |
1.脂肪醇、芳香醇、酚的比较
|
类别 |
脂肪醇 |
芳香醇 |
酚 |
|
实例 |
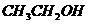 |
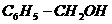 |
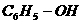 |
|
官能团 |
-OH |
-OH |
-OH |
|
结构特点 |
-OH与链烃基相连 |
-OH与芳烃侧链相连 |
-OH与苯环直接相连 |
|
主要化性 |
(1)与钠反应(2)取代反应(3)脱水反应(4)氧化反应(5)酯化反应 |
(1)弱酸性(2)取代反应(3)显色反应 |
|
|
特性 |
红热铜丝插入醇中有刺激性气味(生成醛或铜) |
与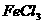 溶液显紫色 溶液显紫色 |
(二)非选择题
19.工业上将磷酸钙、石英砂和炭粉混合,在电炉中焙烧制白磷:
□Ca3(PO4)2+□SiO2+□C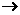 □CaSiO3+□P↑+□CO↑
□CaSiO3+□P↑+□CO↑
1)上述方程式配平后各物质系数依次为
2)反应中得气体密度折成标况下为1.64g/L。据此计算制得白磷相对分子质量 。
3)据计算推断白磷分子组成为 ,其空间结构为 。
知识点:化学方程式的配平、白磷分子结构
能力点:综合思维能力、分析能力
20.有100mL无色混合气体,可能由O2、NO2、CO、N2、HCl、Cl2等气体中的几种组成。当混合气体通过足量的Na2CO3溶液时,气体体积减少了20mL,剩余气体通过灼热的 氧化铜后,气体体积未发生变化,再把剩余气体通过足量的Na2O2时,气体体积又缩小了30mL,最后把余下气体与灼热铜粉充分反应后,体积变为20mL。分析回答:此混合气体由哪几种气体组成?各种气体的体积各是多少毫升?
知识点:考查一些常见气体的性质。
能力点:分析问题的综合能力。
21.三硅酸镁被用来治疗胃溃疡,是因为该物质不溶于水,服用后中和胃酸,作用持久。把三硅酸镁Mg2Si3 O8·nH2O改写成氧化物形式为 ,写出它中和胃酸(HCl)化学方程式: .
知识点:酸碱中和,人体小常识
能力点:综合思维能力,分析、思考能力
22.已知X和Y是短周期元素中同族单质,W、V是化合物,它们有如下反应(式中各物质系数, 反应条件均略去);X+W Y+V。写出符合上述题意并满足下列要求的化学方程式:
Y+V。写出符合上述题意并满足下列要求的化学方程式:
1)W是水:
2)V是水:
3)W、V均是氧化物
知识点:元素周期表、化合物性质
能力点:记忆能力、联想能力、综合思维能力
23.为熔制钾玻璃准备如下材料:360份重石英砂,67.2份重苛性钾和88.8份重熟石灰。假定 这些熔料不含杂质。
1)计算在制得钾玻璃中各氧化物质量分数
2)用氧化物形式表示钾玻璃组成
知识点:玻璃组成、氧化物组成
能力点:综合思维能力、理解能力、计算能力
(一)选择题:
1.下列各组物质中,晶体类型相同且熔点高低比较正确的是( )
A.硅、铝合金>铝 B.SiO2>CO2
C.NaCl>CCl4 D.I2>Br2
知识点:晶体类型及性质
能力点:记忆能力,应用能力
2.能将Na2SiO3、CaCO3、SiO2三种白色粉末鉴别开来试剂是( )
A.苛性钠溶液 B.水
C.氢氟酸 D.稀盐酸
知识点:硅及其化合物性质
能力点:再现能力、分析能力
3.将石墨置于熔融的钾或气态钾中,石墨会吸收钾而形成称为钾石墨的物质,其组成是C8K、C24K、C36K、C48K和C60K。在钾石墨中,钾原子把价电子交 给石墨层,但在遇到与金属钾易反应的其他物质时还会收回。在钾石墨中,钾元素处于石墨 层中间,因而石墨层之间被胀大,层间的距离增加。下列对钾石墨的叙述中正确的是 ( )
A.钾石墨是一类离子化合物
B.钾石墨导电性比石墨强
C.钾石墨与水相遇不发生任何反应
D.题干所举出的5种钾石墨属于同素异形体
知识点:离子化合物的性质
能力点:综合推理能力
4.下列物质有固定熔点是( )
A.玻璃 B.水泥
C.水玻璃 D.Na2O·SiO2
知识点:熔点定义
能力点:理解能力
5.下列叙述中非金属元素,其气态氢化物最稳定( )
A.构成矿物和岩石的主要元素
B.空气中含量最多的元素
C.单质在常温下呈液态的元素
D.地壳中含量最多的元素
知识点:气态氢化物比较
能力点:记忆、理解能力
6.CaC2和MgC2都是离子化合物,下列叙述中正确的是( )
A.MgC2和CaC2都能跟水反应生成乙炔
B.C22-的电子式为[:C C:]2-
C:]2-
C.CaC2在水中以Ca2+和C22-形式存在
D.MgC2的熔点低,可能在100℃以下
知识点:由CaC2的一些性质,类推出MgC2的性质。
能力点:培养学生知识的迁移能力。
7.某些保健品中有锗元素(Ge),它在周期表的第四周期IVA族。有关锗叙述正确的是( )
A.锗原子序数为34
B.Ge可以生成化学式为Na2GeO3的盐
C.锗的金属活泼性应比铝强
D.单质锗是半导体
知识点:元素周期律、氧族元素性质
能力点:理解能力、分析能力
8.把7.4g Na2CO3·10H2O和NaHCO3组成混合物溶于水,配成100mL溶液,其[Na+ ]=0.6mol/L;若把等质量的混合物加热到恒重,残留物的质量是( )
A.5.28g B.4.22g
C.3.18g D.2.12g
知识点:NaHCO3和Na2CO3
能力点:记忆能力、计算能力
9.在下列反应里,氧化剂和还原剂物质的量比与质量比一致的是( )
A.Cl2+H2O HClO+HCl
HClO+HCl
B.H2S+SO2 S↓+H2O
S↓+H2O
C.SiO2+C SiC+CO↑
SiC+CO↑
D.Si+O2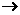 SiO2
SiO2
知识点:方程式配平、氧化还原定义
能力点:理解能力、应用能力
10.不加任何试剂就可将①Na2SiO3 ②Na2SO4 ③CaCl2 ④KCl ⑤Ba (NO3)2五种溶液鉴别出来,其鉴别检出顺序是( )
A.③④⑤①② B.③①⑤②④
C.①③④②⑤ D.③②①④⑤
知识点:沉淀、气体
能力点:实验能力、发散思维能力
11.若发现114号新元素X,它的最外层有四个电子,则下列有关它的叙述中,正确的是( )
A.X有稳定的气态氢化物XH4
B.X的最高正价氧化物是XO2
C.X应为非金属元素
D.X的低价氧化物是酸性氧化物
知识点:元素周期表,氧族元素
能力点:理解能力、想象思维能力
1996年的诺贝尔化学奖授予了致力研究碳的球状问题结构的三位化学家。碳的球状结构,就 是富勒烯家族的由若干个碳原子组成的比较稳定的笼状结构分子,其典型代表为C60 。已测知其球状分子结构的表面上存在有共轭双键(由一个单键隔开的两个双键)。试根据以上叙述回答12、13两小题。
12.C60与金刚石、石墨互为( )
A.同分异构体 B.同系物
C.碳的同位素 D.碳的同素异形体
知识点:同分异构体、同位素、同系物、同素异形体的概念。
能力点:知识再现能力。
13.C60晶体存在的作用力有( )
①离子键;②非极性键;③极性键;④范德华力;⑤不饱和键。
A.①、②、⑤ B.②、④、⑤
C.②、③、④ D.④、⑤
知识点:离子键,极性键、非极性键、范德华力的概念。
能力点:记忆能力、理解能力
14.下列说法正确的是( )
A.二氧化硅是原子晶体,不存在单个分子,“SiO2”表示的是晶体中硅、氧原子的最简个数比而不是一个分子组成。
B.石英玻璃的膨胀系数是普通玻璃的1/18,故不能用于制造耐高温化学仪器
C.工业上用碳还原二氧化硅制粗硅,在反应中氧化剂与还原剂质量比是5∶2
D.二氧化硅熔沸点比二氧化碳高,是由于Si-O键比C-O键的键能大。
知识点:二氧化硅性质
能力点:记忆能力、发散思维能力
15.由元素X形成两种氧化物A和B,已知A中含X 42.86%,B中含X 27.27%,若A分子式为XO,则B分子式为( )
A.XO3 B.X2O
C.X2O3 D.XO2
知识点:氧化物
能力点:计算能力、分析能力
16.四氯化硅结构和四氯化碳类似,对其性质判断①四氯化硅是分子晶体;②常温下为液态;③四氯化硅沸点较低;其中正确的是( )
A.只有① B.①③
C.②③ D.①②③
知识点:晶体类型和结构
能力点:迁移能力、联想能力
17.将24g石英和80g石灰石在高温下充分反应,反应后放出气体在标况时的体积是( )
A.8.96L B.17.92L
C.4.48L D.11.2L
知识点:石英性质
能力点:计算能力
18.某种H2和CO的混合气体。其密度为同条件下O2密度的1/2。将3.2g这种混合气体充入一盛有足量的Na2O2的密闭容器中,再通入足量O2,并用电火花点燃使其充分反应。 最后容器中固体的质量增加了( )
A.3.2g B.4.4g
C.5.6g D.6.4g
知识点:考查CO的还原性
能力点:计算能力、综合思维能力
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com