
题目列表(包括答案和解析)
1.铁的重要氧化物的比较
|
铁的氧化物 |
FeO |
Fe2O3 |
Fe3O4 |
|
色态 |
黑色粉末 |
红棕色粉末 |
铁黑色晶体 |
|
铁的价态 |
+2 |
+3 |
+2,+3 |
|
水溶性 |
不溶 |
不溶 |
不溶 |
|
铁的氧化物与盐酸反应 |
FeO+2HCl=FeCl2+H2O |
Fe2O3+6HCl=2FeCl3+3H2O |
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O |
|
铁的氧化物与CO反应 |
FexOy+yCO xFe+yCO2 xFe+yCO2 |
4.从原理、设备、生产过程、原料及氧化--还原反应的角度比较并掌握工业炼铁和炼钢。
3.了解铁的合金(生铁、钢)的种类、成分、性能。
2.学会检验Fe3+的方法。
1.掌握铁和铁的一些重要化合物的性质。
(二)非选择题
13.美籍埃及人泽维尔用激光闪烁照相机拍摄到化学反应中化学键断裂和形成的过程,因而获得1999年诺贝尔化学奖。激光有很多用途,例如波长为10.3微米的红外激光能切断 分子中的一个B-C键,使之与HBr发生取代反应:
分子中的一个B-C键,使之与HBr发生取代反应:

而利用9.6微米的红外激光却能切断两个B-C键,并与HBr发生二元取代反应。
(1)试写出二元取代的化学方程式:___________。
(2)现用 和9.72gHBr正好完全反应,则生成物中除了甲烷外,其他两种产物的物质之比为多少?
和9.72gHBr正好完全反应,则生成物中除了甲烷外,其他两种产物的物质之比为多少?
14.A、B都是芳香族化合物,1molA水解得到1molB和1mol醋酸。A、B的相对分子质量都不超过200,完全燃烧都只生成 和
和 。且B分子中碳和氢元素总的质量分数为65.2%。A溶液具有酸性,不能使
。且B分子中碳和氢元素总的质量分数为65.2%。A溶液具有酸性,不能使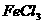 溶液显色。
溶液显色。
(1)A、B的相对分子质量之差为__________。
(2)1个B分子中应该有___________个氧原子。
(3)A的分子式是______________。
(4)B可能的三种结构简式是___________。
15.有机物E和F可用作塑料增塑剂或涂料中的溶剂。它们的分子量相等,可用以下方法合成

请写出:有机物的名称A___________、B___________化学方程式:
A+D→E___________
B+G→F___________
X反应的类型及条件:类型___________条件___________
E和F的相互关系属___________(多选扣分)
同系物②同分异构体③同一种物质④同一类物质
16.通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构:
 ,下图是9个化合物的转变关系。
,下图是9个化合物的转变关系。

(1)化合物①是___________,它跟氯气发生反应的条件是___________。
(2)化合物⑤跟⑦可在酸的催化下去水生成化合物⑨,⑨的结构简式是___________,名称是___________。
(3)化合物⑨是重要的定香剂,香料工业上常用化合物②和⑧直接合成它。此反应的化学方程式是___________。
(一)选择题
1.现有一系列稠环芳香烃,按如下特点排列:

A. B.
B.
C. D.
D.
2.分别燃烧下列各组物质中的两种化合物,所得 和
和 的物质的量之比相同的有( )
的物质的量之比相同的有( )
A.乙烯、丁二烯
B.乙醇、乙醚
C.苯和苯酚
D.醋酸、葡萄糖
3.下列有机物各1mol,完全燃烧需氧气最多的是( )
A. B.
B.
C. D.
D.
4.对于结构简式为:
 的维生素A,有如下各种说法,①维生素A是一种醇,②1摩维生素A在催化剂作用下,可与5摩
的维生素A,有如下各种说法,①维生素A是一种醇,②1摩维生素A在催化剂作用下,可与5摩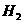 加成,③维生素A的分子中有苯环结构,④维生素A具有环已烷的结构,⑤维生素A的分子式为
加成,③维生素A的分子中有苯环结构,④维生素A具有环已烷的结构,⑤维生素A的分子式为 ,⑥维生素A有异戊二烯的结构单元。上述各说法中正确的是
,⑥维生素A有异戊二烯的结构单元。上述各说法中正确的是
A.①③④⑤
B.②④⑤⑥
C.①②③④
D.①②⑤⑥
5.在灼热铜丝网的作用下,1-丙醇跟空气中氧气反应生成一种化合物。 与该化合物互为同分异构体的有( )

6.现有4种有机物:

其中一氯取代物的同分异构体数目相同的是( )
A.①和②
B.②和③
C.①和③
D.②和④
7.白黎芦醇 广泛存在于食物(例如桑椹、花生、尤其是葡萄酒)中,它可能具有抗癌性。能够使1mol该化合物起反应的
广泛存在于食物(例如桑椹、花生、尤其是葡萄酒)中,它可能具有抗癌性。能够使1mol该化合物起反应的 和
和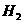 的最大用量分别为()
的最大用量分别为()
A.1mol,1mol
B.3.5mol,7mol
C.3.5mol,6mol
D.6mol,7mol
8.邻羟基苯甲酸,俗名水杨酸,其结构简式为 ,当与物质A的溶液反应生成化学式为
,当与物质A的溶液反应生成化学式为 的盐,A可以是下列中的( )
的盐,A可以是下列中的( )
A.NaCl
B.
C.NaOH
D.
9.根据柠醛的结构简式为 ,判断如下各有关说法中不正确的是( )
,判断如下各有关说法中不正确的是( )
A.它可以使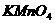 酸性溶液褪色。
酸性溶液褪色。
B.它可以使溴水褪色
C.它可以与银氨溶液发生银境反应
D.它的催化加氢反应产物的分子式为
10.下列各物质,只用一种试剂就可鉴别的是( )
A. 、
、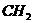 =
=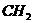 、CH≡CH、
、CH≡CH、
B. 、HCOOH、
、HCOOH、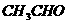 、
、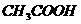
C. 、
、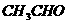 、
、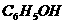 、
、

11.若1摩气态烃能跟2摩HCl加成,而加成产物又可以和6摩 完全取代,则该烃是( )
完全取代,则该烃是( )
A.2-甲基丙烯
B.乙炔
C.1,3-丁二烯
D.丙炔
12.环状化合物 是一种重要的有机试剂,它可由有机化工原料R和其它无机原料发生加成、水解、氧化、酯化反应制得,R是( )
是一种重要的有机试剂,它可由有机化工原料R和其它无机原料发生加成、水解、氧化、酯化反应制得,R是( )
A.1-丁烯
B.乙块
C.1,3-丁二烯
D.乙烯
13.1995年3月20日在日本东京地铁发生了震惊世界的“沙要毒气袭击事件”,造成11人死亡,5500多人中毒,恐怖分子使用的“沙林”是剧毒的神经毒剂,它的化学“各称”为甲氟磷酸异丙酯。已知甲氟磷酸的结构是 ,则“沙林”的结构简式就为( )
,则“沙林”的结构简式就为( )

(五)正确利用新信息迁移题,培养分析问题,解决问题的能力。
新信息迁移题,其特点是在题中联系社会实践和科学发展给予一定量的新的问题情境或有关信息,结合教材中所学知识而构成的一类新题型。在解题过程中,可体会到一些科学、社会的发展与化学学科间的重要性质,接触并学习一些新知识,从而提高自身的科学素养和文化素质,同时达到培养自学能力、信息接受和处理能力、问题的分析和解决能力。
在解析信息迁移题时,首先是全面地、认真地分析题中给予的信息内容、要点和规律,然后迁移到教材中有关的知识内容上,解决题中要求的问题。

[同步达纲练习]
(四)定量认识有机物之间的相互反应。
在学习有机物的化学性质、制备和检验时,都要涉及有关的反应,对待反应的化学方程式,除了明确反应物,生成物的组成和结构以及反应条件等定性内容之外,还必须同时明确各物质之间的定量关系,不断强化理解学习的定量意识,现通过一些具体反应,举例说明如下:
(1)在烷烃和芳香烃与卤素( )的一卤取代反应中,被取代的H原子和卤素单质及生成的卤代烃物质的量之比为1∶1∶1。
)的一卤取代反应中,被取代的H原子和卤素单质及生成的卤代烃物质的量之比为1∶1∶1。
(2)在不饱和烃与氢气或卤素的加成反应中,C=C双键与氢气或卤素单质的量之比都是1∶1,若是C≡C叁键,则为1∶2
(3)当醇与金属钠反应时,醇羟基和反应消耗的Na及生成氢气物质的举之比为2∶2∶1。若醇羟基换成酚羟基或羰基,与金属钠反应时,也有同样的量关系。
(4)当醇被氧化成醛或酮时,反应中被氧化的醇羟基和消耗的 与生成C=O双键、
与生成C=O双键、 物质的量之比为2∶1,2∶2;若将氧化剂
物质的量之比为2∶1,2∶2;若将氧化剂 换成CuO,上述量关系为1∶1∶1∶1。
换成CuO,上述量关系为1∶1∶1∶1。
(5)在银镜反应中,醛基和消耗的 与生成的羟基、析出Ag物质的量之比为1∶2:1∶2。
与生成的羟基、析出Ag物质的量之比为1∶2:1∶2。
在醛和新制的 浊液反应时,醛基、
浊液反应时,醛基、 和生成的羰基、
和生成的羰基、 物质的量之比为1∶2:2∶1。
物质的量之比为1∶2:2∶1。
(6)在有机物(CxHyOz)完全燃烧的反应中,有机物和消耗的氧气、与生成的 、
、 物质的量之比为:
物质的量之比为:
 。
。
(三)重视各类物质性质的比较和分析,培养综合归纳的能力
在有机化学的学习过程中,分别对各类有机物的主要性质,尤其是化学性质,有了比较系统的掌握之后,应注意,各类物质性质的横向比较,认识不同类的相关有机物在性质上的异同。这本身也中对各种有机物性质的分析和归纳,见前面知识结构内容。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com