
题目列表(包括答案和解析)
14. 在一恒定的容器中充入2molA和1 mol B发生反应:2A(g)+B(g) x C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:
在一恒定的容器中充入2molA和1 mol B发生反应:2A(g)+B(g) x C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:
13.在一定温度时将x克某物质A完全溶解于50克水中,若将所得的溶液蒸发掉10克水后并恢复至原来温度,可析出A物质a克,再蒸发掉10克水后仍恢复至原温度,又析出A物质b克,最后将剩余溶液蒸干,得到A物质y克。若A物质不含结晶水,则x与y的比值为( )
A.(a+4b)/3b B.(a+4b)/4b C.(a+3b)/2b D.(a+3b)/3b
12.R为短周期元素,其原子所具有的电子层数为最外层电子数的1/2,它可能形成的常见含氧酸根离子有:(1)R2O42- (2)RO42- (3)R2O32- (4)RO32-。下列判断正确是( )
A.若它能形成(1)时,则不可能形成(2),(3)
B. 若它能形成(2)时,则还可以形成(3),(4)
C. 若它能形成(1)时,则不可能形成(4)
D.若它能形成(2)时,则可以形成(1)
11.将一定量的锌与100mL 18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的pH=1,则下列叙述中错误的是( )
A.气体A为SO2和H2的混合物 B.气体A中SO2与H2的体积比为4:1
C.反应中共消耗Zn97.5g D.反应中共转移电子3mol
10.设NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4LCO2与CO的混合气体中约含有碳原子数为NA
B.活泼金属与盐酸反应,每放出1molH2,其电子转移的数目为NA
C.在常温常压下,1mol氩气含有的原子数为2NA
D.常温常压下,22.4LN2所含有的分子数多于NA
9.下列反应的离子方程式错误的是( )
A.等物质的量的Ba(OH)2和NH4HSO4在溶液中反应
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+H2O
B.用NaOH溶液吸收少量H2S:
OH-+H2S=HS-+H2O
C.足量的CO2通入饱和碳酸钠溶液中
CO2+CO32-+H2O=2HCO3-
D.向碳酸氢钠溶液中滴入少量澄清石灰水
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
8.氢氧电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液。以下有数种说法:
(1)负极反应为O2+2H2O+4e-→4OH-
(2)负极反应为2H2+4OH--4e-→4H2O
(3)电池工作时正极区pH升高,负极区pH下降
(4)电池工作时溶液中的阴离子移向正极
正确的组合是( )
A.(2)(3) B.(2)(4) C.(1)(3)(4) D.(1)(4)
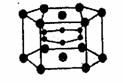
7.2001年报道镁和硼形成的化合物刷新了金属化合物超导温度的最高记录。如图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;
6个硼原子位于棱柱内。则该化合物的化学式可表示为
A.MgB2 B.MgB C.Mg2B D.Mg3B2
6.最近科学家冶炼出了纯度高达99.999%的铁,估计它不会具有的性质是( )
A.硬度比生铁低 B.在潮湿的空气中放置不易生锈
C.与4mol/L盐酸的反应速率比生铁快
 D.在冷的浓硫酸中可以钝化
D.在冷的浓硫酸中可以钝化
5.若以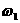 和
和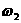 分别表示浓度为a mol /L和b mol/L氨水的质量分数,且知a=2b,则下列推断正确的是(氨水和密度比纯水的小)
分别表示浓度为a mol /L和b mol/L氨水的质量分数,且知a=2b,则下列推断正确的是(氨水和密度比纯水的小)
A.2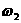 =
=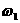 B.
B.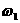 <2
<2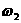 C.
C.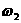 <
<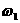 <2
<2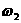 D.
D.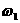 >2
>2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com