
题目列表(包括答案和解析)
20.(1)碳酸钠、碳酸镁、碳酸锂、碳酸铍
(2)MB 〉MA 〉MC 或 MC 〉MA 〉MB
(3)2 MgCO3 Li2CO3
(4)MgCO3、BeCO3、Na2CO3 1.05:1
19. (1) Na > Mg > C > O
(2) NaOH Mg(OH)2


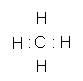 (3)
,极性共价 非极性 0=C=O
(3)
,极性共价 非极性 0=C=O
‥‥
(4) Na+[:O:O:]2-Na+
‥‥
9.C 10.BD 11.CD 12.BC 13.B 14.D 15.B 16.B 17.B 18.C
26、(9分)相对原子质量大于10的两种元素X、Y,能形成两种化合物A、B。已知A分子中X和Y原子个数比为1:2,A在标准状况下的密度为2.86
g•L-1;又知B分子中有一个X原子,B对氧气的相对密度为2.5。推算:
(1) X和Y两元素的名称
(2) A和B的分子式。
答案:1.C 2.B 3.C 4.A 5.B 6.C 7.C 8.A
25、(7分)已知A和B两元素的单质气体在同温同压下能以体积比2:1完全化合成C气体,且反应后的气体体积比反应前的气体体积减小1/3。通过计算证明B元素的单质一定不是单原子分子。
24、(8分)人类最早使用的火药是黑火药,它是1500年前我国古代炼丹家发明的,它的使用对于促进世界进步有着深远的意义。黑火药爆炸时发生的反应主要为:(未配平)
(1)配平:____KNO3 + ___S + ___C = ___K2S + ___CO2↑ + ___N2↑
(2)1mol氢气燃烧时约放出286kJ的热量,而每千克汽油燃烧放热46000kJ,氢气被公认为21世纪替代矿物燃料的理想能源。试简述氢气作为能源时的三个主要优点:
①________________________________________________,
②____________________________________ ,
③__________________________________________ 。
23、(12分)由于Fe(OH)2极易被氧化,所以实
验室很难用亚铁盐和烧碱反应制得白色纯净
的Fe(OH)2沉淀,应用右图所示方法可制得
白色纯净的Fe(OH)2沉淀,两电极材料分
别是石墨和铁。
(1)a极材料应为________,a电极的电极反应式为
_____________________________________________。
(2)电解液c可以是(填字母)___________
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为_______________________________________,在加入苯之前,对c溶液应作何简单处理____________________________
________________________________________________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施是___________。
A、改用稀硫酸作电解质溶液
B、适当增大电源的电压
C、适当减小两电极间的距离
D、适当降低电解液的浓度
21(9分)用一种试剂除去杂质(括号内物质),写出所用试剂的化学式及反应的离子方程式。
(1) CO2(HCl):试剂是____________________________,离子方程式为________________________ 。
(2) FeCl2(FeCl3): 试剂是________________________,离子方程式为_______________ _。
(3) N0(NO2): 试剂是____________________________,离子方程式为______________________ _。
22(10分)已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子的催化下可以发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式:
____________________________________________________。
(2)此反应的氧化剂是_______,氧化产物是__________。
(3) 此反应的离子方程式可表示为:_________________________________。
(4)若将该反应所用的硫酸锰改为氯化锰(MnCl2),当它跟过量的过硫酸钾反应时, 除有高锰酸钾、硫酸钾和硫酸生成外,还有__________生成。
 19(10分)W、X、Y、Z四种短周期元素的原子序数X > W > Z > Y。W原子最外层电子数不超过最内层电子数。X原子L层电子数是其它各层电子总数的2倍。Y原子最外层电子数是次外层电子数的2倍。Z和W可形成W2Z和W2Z2两种化合物。
19(10分)W、X、Y、Z四种短周期元素的原子序数X > W > Z > Y。W原子最外层电子数不超过最内层电子数。X原子L层电子数是其它各层电子总数的2倍。Y原子最外层电子数是次外层电子数的2倍。Z和W可形成W2Z和W2Z2两种化合物。
(1) 四种元素原子半径从大到小的顺序为_______________________(填元素符号)
(2) W、X元素的最高价氧化物对应的水化物的碱性________强于__________
(填化学式)
(3) Y所形成的气态氢化物分子的电子式为__________,是由_______键构成的_______性分子,其最高价氧化物分子的结构式是_____________。
(4)
 W单质在Z单质中燃烧所得生成物的电子式为_______________。
W单质在Z单质中燃烧所得生成物的电子式为_______________。
20(12分)A.B.C是短周期ⅠA和ⅡA族元素的碳酸盐,他们的质量分别为mA、mB、mC,与足量的盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。已知:mA = mB + mC , nA(HCl) = nB(HCl) + nC(HCl).请填空:
(1) 写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐(正盐)的名称 _________________________________________。
(2)若以MA、MB、MC分别表示A、B、C的相对分子质量,试写出MA、MB、MC三者的关系式_______________________________________________。
 (3)A的正确选择有_____种,其化学式为___________________________。
(3)A的正确选择有_____种,其化学式为___________________________。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次为_____________________,mB :mC = ________。(保留2位小数)
18、往100mLFeBr2溶液中缓慢通入2.24L(标准状况)氯气,反应完全后溶液中有1/3的溴离子被氧化成溴单质,则该FeBr2 溶液的物质的量浓度为(不考虑氯气与水的反应) ( )
A.0.1mol/L B.2.0 mol/L C.1.2 mol/L D.2.4 mol/L
 第Ⅱ卷 非选择题(共78分)
第Ⅱ卷 非选择题(共78分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com