
题目列表(包括答案和解析)
19、(8分)
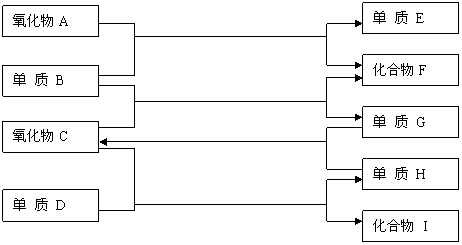
高温
反应①

高温
反应②
燃烧
反应③
高温
反应④
如上图,已知:
①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水呈酸性,它能够跟氧化物A起反应。
据此,请填空:
⑴化合物F是 。⑵化合物I 是 。
⑶反应③的化学方程式是
⑷反应④的化学方程式是
18、(6分)下表数据是在某高温度下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
|
反应时间 t/h |
1 |
4 |
9 |
16 |
25 |
|
MgO层厚Y/nm NiO层厚Y′/nm |
0.05a b |
0.20a 2b |
0.45a 3b |
0.80a 4b |
1.25a 5b |
*注:a和b均为与温度有关的常数
请填空回答:
⑴金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是
。
⑵金属氧化膜的膜厚Y跟时间t所呈现的关系是(填直线、抛物线、对数或双曲线等类型):MgO氧化膜厚Y属 型,NiO氧化膜厚Y′属 型。
⑶Mg与Ni比较,哪一种金属具有良好的耐氧化腐蚀性: ,其理由是:
。
17、(6分)设X、Y、Z代表3种元素。已知:①X+和Y-两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9个;③Y和Z两元素可以形成四核42个电子的负一价阴离子。据此,请填空:
⑴Y元素是 ,Z元素是 。
⑵由X、Y、Z三元素所形成的含68个电子的盐类化合物之分子式(即化学式)是
16、为了测定某烷烃样品(丁烷,并含少量丙烷等气态烃)的平均分子量,设计了下面的实验:①取一个配有合适胶塞的洁净、干燥的锥形瓶,准确称量,得到质量m1 ②往锥形瓶中通入干燥的该烷烃样品,塞好胶塞,准确称量;重复操作,直到前后两次称量结果基本相同,得到质量m2 ③往锥形瓶内加满水,塞好胶塞,称量得到质量m3 已知实验时的温度T(K),压强P(Kpa),水的密度 (g·L-1)空气的平均分子量29.0,密度
(g·L-1)空气的平均分子量29.0,密度 (g·L-1),回答下面问题:
(g·L-1),回答下面问题:
⑴本实验的原理是(具体说明)
⑵步骤②中为什么要重复操作,直到前后两次称量结果基本相同?
⑶具体说明本实验中怎样做到每次测量都是在相同条件下进行的?
⑷本实验中收集气体样品的操作,可选用的方法是(填图中标号)

⑸锥形瓶内空气的质量( )是
(列出算式)。
)是
(列出算式)。
⑹瓶中样品的质量( )是
(列出算式)。
)是
(列出算式)。
⑺由实验测得该烷烃的平均分子量是 (列出算式)。
15、下列溶液经反应后,溶液内含有0.50 mol NaHCO3和0.50 mol Na2CO3的是
A 0.50L 1.00 mol·L-1NaHCO3加0.50L 0.50 mol·L-1NaOH
B 0.50L 0.75 mol·L-1 Na2CO3加0.50L 0.50 mol·L-1 HCl
C 0.50L 1.00 mol·L-1 NaHCO3 加0.50L 0.25 mol·L-1 NaOH
D 1.00L 1.00 mol·L-1 Na2CO3 加1.00L 0.50 mol·L-1 HCl
14、已知甲醛(HCHO)分子中的4个原子共平面的。下列分子中所有原子不可能同时存在于同一个平面上的是


A 苯乙烯 B 苯甲酸


C 苯甲醛 D 苯乙酮
13、某烃室温时为气态,完全燃烧后,生成的H2O和CO2的物质的量之比为3:4。该不饱和烃的链状同分异构体的数目应是
A 2 B 3 C 4 D 5
12、甲、乙、丙三种不同浓度的稀H2SO4,分别跟等物质的量的Al、KHCO3和K2CO3刚好反应完全,所耗去甲、乙、丙三种酸的体积比为1:2:3,则甲、乙、丙三种酸物质的量之比应是
A 1:1:1 B 3:1:2 C 6:3:2 D 18:3:4
11、相同质量的四份铜片,分别置于足量的下列酸中,所得到的气体的物质的量最多的是
A 浓硫酸 B 稀硫酸 C 浓硝酸 D 稀硝酸
10、下列溶液,一定呈中性的是
A 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
B [H+]=1×10-7mol·L-1 的溶液 C pH=14-pOH 的溶液 D pH=pOH 的溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com