
题目列表(包括答案和解析)
6.下列各组离子:①I- ,ClO- ,NO3- ,H+ ; ②K+ ,NH4+,HCO3- ,OH- ;
③SO32-,SO42- ,Cl- , OH- ;④Fe3+ ,Cu2+ , SO42- , Cl- ; ⑤H+ , K+ ,AlO2- ,HSO3-;
⑥Ca2+ ,Na+ , SO32-,SO42-,在水溶液中大量共存的是
A.①和⑥ B.③和④ C.②和⑤ D.①和④
5.下列各对物质中,属于同分异构体的是
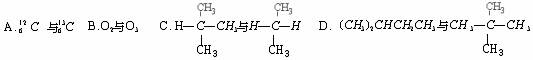
4.镭是元素周期表中第ⅡA族元素,下列对于镭的叙述不正确的是
A.镭比钙的金属性更强 B.在化合物中呈+2价
C.镭是一种放射性元素 D.氢氧化镭呈两性
3.为了降低燃煤燃烧时产生的SO2污染,常在燃煤中掺入一定量的石灰,工业上称为“钙基固硫”,此时燃煤中S元素燃烧时转化为
A.CaS B.CaSO3 C.CaSO4 D.CaS2O3
2. 工业制硫酸排放的尾气中含有的SO2是大气的一种重要污染物,对SO2描述错误的是
A.大气中SO2主要来自硫酸厂排放的废气
B.大气中SO2主要来自生产、生活中燃料(如:煤)的燃烧
C.SO2对人体的直接危害是引发呼吸系统疾病
D.SO2不仅直接导致大气污染,还能导致土壤污染,水污染等二次污染
硫酸是化学工业常见的重要酸之一,工业上用黄铁矿,空气、水制取硫酸,回答以下1-3题
1.下列叙述正确的是
A.黄铁矿石在燃烧炉中加热煅烧 B.生产过程中需通入适当过量的空气
C.接触室中使用催化剂来提高SO2的转化率 D.吸收塔中用水吸收SO3,形成浓硫酸
14. (1)向外轻轻拉动注射器的活塞;浸没在水中的玻璃导管口有气泡冒出;(2)蓝、无SO2+I2+2H2O=H2SO4+2HI
(3)
|
分组 |
第一小组 |
第二小组 |
|
抽气次数 |
120 |
140 |
|
SO2含量/mg·m-3 |
0.53 |
0.46 |
三级:第一;抽气速度过快,造成空气中SO2无法与碘水充分反应,产生较大的误差。
此装置的特殊性有两点:其一,除玻璃导管与大气相通外,注射器活塞可移动,若加热不便观察现象(注射器轻微移动不易看到);其二,橡胶管连有单向阀,抽气时,使空气通过玻璃导管进入试管与A溶液反应,推动注射器时,直管的单向阀关闭,残气从单向阀的支管排出。据此,只能拉动注射器直接检查气密性。
13. (1)N2、O2的体积(2)偏低 (3)酸性高锰酸钾或溴水 (4)V(SO2)=22.4CVa/(22.4CVa+Vb)
(5) bceg 或 beg 或 ceg
本题为信息型实验设计题,必须在接受有关信息的基础上,联系有关知识解决问题。信息1:混合气体中含有:SO2、N2、O2 ;信息2:N2、O2不与I2反应,SO2和I2发生反应为:SO2+I2+2H2O==H2SO4+2HI;旧知识:碘使淀粉显蓝色。(1)混合气体进入反应管后,SO2和I2发生反应,N2、O2不反应。故增加的水的体积等于N2、O2的体积。(2)反应管内溶液蓝色消失后,此时溶液中的I2已与SO2反应完全,继续通气,SO2气体也被排出,计入了N2和O2的体积,故测得的SO2含量偏低。(3)能与SO2反应且有颜色改变的均可代替碘的淀粉溶液。如:酸性高锰酸钾或溴水。
12. (1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O向下排空气 碱石灰(2)打开止水夹,挤出胶头滴管中的水。氢气极易溶解于水,致使烧瓶内气体压强迅速减小。(3)D(4)C (5)打开夹子,用手(或热毛巾等)将烧瓶捂热,氢气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
2NH3↑+CaCl2+2H2O向下排空气 碱石灰(2)打开止水夹,挤出胶头滴管中的水。氢气极易溶解于水,致使烧瓶内气体压强迅速减小。(3)D(4)C (5)打开夹子,用手(或热毛巾等)将烧瓶捂热,氢气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
该实验以喷泉实验为背景命题,其中第(5)问,说明引发喷泉的方法,答案不唯一,是一道开放性实验题,(2)(3)(4)(5)问,源于教材,又高于教材,突出考察了运用基础知识和基本原理解决实验问题的能力。图1是教材中的原图,图2去掉了原有的胶头滴管,创设了新情境,要求考生在已经掌握了喷泉实验操作及实验原理的基础上,说明图2装置引发喷泉的实验方法,考生必须想出办法让氨气与水接触,问题才能迎刃而解。是考察逆向思维和创新精神的好题。
11. (1)避免和减少空气中的氧气对Fe(OH)2氧化 4Fe(OH)2+O2+2H20=4Fe(OH)3 溶入NaOH溶液的02,溶入FeSO4溶液的02,空气中的O2。
(2)方法一①稀H2SO4和铁屑 ②煮沸 ③避免生成的Fe(OH)2沉淀接触O2
(3)方法二:①稀H2SO4和铁屑 ②NaOH溶液 ③检验试管II出口处排出氢气的纯度。当排出的氢气纯净时,再夹紧止水夹 ④试管I中生成的H2充满了试管I和试管II,且外界空气不容易进入。
本题考查有三个侧重点:一是侧重考查考生解决问题的创新思维能力;二是侧重考查考生的语言文字表达能力;三是侧重考查考生的实验能力。题目设计巧妙,源于教材又高于教材。用FeSO4溶液与NaOH溶液反应制备Fe(OH)2并观察沉淀的颜色变化是高二教材重要的演示实验。方法一要求考生不但要知道怎样做该实验,还要求考生掌握为什么这样做?方法二设计制备Fe(OH)2的新方法,要求在制备过程中沉淀不转化,高于教材。Fe(OH)2、FeSO4均易被氧化,FeSO4又易水解。在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备白色Fe(OH)2沉淀,首先要排出大试管及稀H2SO4溶液与NaOH溶液中溶解的空气。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com