
题目列表(包括答案和解析)
1、(1996)下列说法正确的是(N0表示阿伏加德罗常数的值) .
A 标准状况下,以任意比混和的甲烷和丙烷混和物22.4升,所含分子数为N0
B 标准状况下,1升辛烷完全燃烧后,所生成气态产物的分子数为8N0/22.4
C 常温常压下,活泼金属从盐酸中置换出1摩H2,发生转移的电子数为2N0
D 常温常压下,1摩氦气含有的核外电子数为4N0
26、(10分)已知可逆反应CO+H2O(g)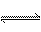 CO2+H2,达到平衡时,K=
CO2+H2,达到平衡时,K= ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c(CO)=2 mol/ L,c(H2O)=3 mol/ L,平衡时CO的转化率为
60%,水蒸气的转化率为____________ ;K值为____________。
(2)830K时,若只将c(H2O)的起始浓度改为6 mol/ L,则水蒸气的转化率为___________。
(3)若830K时,起始浓度c(CO)=a mol/ L,c(H2O)=b mol/ L,H2的平衡浓度
c(H2)=c mol/ L,
①a、b、c之间的关系式是__________________________;
②当a=b时,a=_______c.。
北京市东城区2004-2005学年度第一学期期末教学目标检测
25、NaHCO3和 KHCO3的混合物6.2g与100mL 盐酸恰好完全反应,得到标准状况下CO2的体积为1.568L。
求(1)混合物中NaHCO3的质量是多少?
(2)盐酸的物质的量的浓度是多少?
|
24、(16分)2004年是俄国化学家马尔柯夫尼柯夫(V.V.Markovnikov,1838-1904)逝世100 周年。马尔柯夫尼柯夫因为提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
|
 已知:CH3CH2CN CH3CH2COOH
已知:CH3CH2CN CH3CH2COOH
以下是某有机物F的合成路线,请填写下列空白。
|
|

|
|
|


 CH3CH=CH2
A
B
CH3CH=CH2
A
B
|

|
 F
F

 -CH=CH2
C
D
-CH=CH2
C
D

(1)写出下列物质的结构简式A___________________,C___________。
(2)反应①的反应类型是____________,反应②的反应类型是____ _________。
(3)写出 ③的化学方程式_____________________________________________。
(4)写出与D互为同分异构体、结构中含有苯环且苯环上含有一个甲基(苯环上的取代基处于对位)的酯类的结构简式:
23、(10分)烃A1、A2互为同分异构体,它们各加1molH2都可得到烃B。A1、A2各加1molHCl都得到C1。而B在光照下与氯反应,只得到两种一氯代烃C1和C2。B中碳的质量分数为83.7%。

则 A1、A2、B和C1、C2的结构简式分别是
A1_________________,A2_________________,
B__________________,C1___________________,C2________________。
22、(12分)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B=H++HB-
HB-  H++B2-
H++B2-
回答下列问题:
(1)Na2B溶液显___________(填“酸性”,“中性”,或“碱性”)。
理由是 (用离子方程式表示)
(2)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是_________。
A.c(B2-)+c(HB-)+c(H2B)=0.1mol·L-1
B. .c (Na+)+c(OH-)=c(H+)+c(HB -)
C.c (Na+)+c(H+)=c(OH-)+c(HB -)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol/L NaHB溶液的pH=2,则0.1 mol/ LH2B溶液中氢离子的物质的量浓度可能是 0.11 mol/L(填“<”,“>”,或“=”),理由是:
。
(4)0.1 mol/L NaHA溶液中各种离子浓度由大到小的顺序是________________________________。
21、(8分)在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,有关反应的离子方程式是_________________________;在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,,有关反应的离子方程式是_____________________________________________。从以上事实可知,ClO-、I2、SO42-的氧化性由弱到强的顺序是_____________________________。
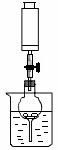
20、(11分)下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
|

|


|

I Ⅱ
(1)铜与稀硝酸反应的离子方程式____________________________________________________。(2)I实验装置中能否证明铜与稀硝酸反应生成的是NO 气体__________(填“能”或“不能”),简述理由___________________________________________________________。
(3)若用Ⅱ实验装置进行实验,以证明铜与稀硝酸反应生成的气体是NO,则:检查气密性的操作是_____________________________________________________________________________;在烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽取干燥管内的空气,稀硝酸沿着干燥管慢慢上升,直到充满整个干燥管,停止抽拉注射器,关闭止水夹,观察干燥管内的现象_________________________________________________________________________________________________。反应停止后,打开止水夹,用注射器抽取干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,观察到的现象是____________________________。
(4)上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是______________________。
19、(5分)现用已知物质的量的浓度为a mol/L的标准盐酸去测定V mL的NaOH溶液的物质的量的浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是__________________________. (2)下图是酸式滴定管中液面在滴定前后的读数:


|
|||
|
滴定前 滴定后
c(NaOH)= _________________________。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量的浓度会偏_____。
18、近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:
KI+3H2O KIO3+3H2↑。下列有关说法正确的是 (BD)
KIO3+3H2↑。下列有关说法正确的是 (BD)
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I――6e-+3H2O=IO3-+6H+
C.溶液调节至强酸性,对生产有利
D.电解前后溶液的pH几乎不变
第Ⅱ卷(78分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com