
题目列表(包括答案和解析)
9、有人曾建议用AG表示溶液的酸度,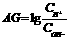 。下列表述正确的是
。下列表述正确的是
A、在25℃时,若溶液呈中性,则PH=7,AG=1
B、在25℃时,若溶液呈酸性,则PH<7,AG<0
C、在25℃时,0.1mol/L盐酸的PH=1,AG=12
D、在25℃时,溶液的PH与AG的换算公式为AG=2(7-PH)
8、可逆反应:3A(g)  3B(?)+C(?),△H>0,随着温度升高,气体的平均相对分子质量变小,则下列判断正确的是:
3B(?)+C(?),△H>0,随着温度升高,气体的平均相对分子质量变小,则下列判断正确的是:
A、B和C可能都是固体 B、B和C一定都是气体
C、若C为固体,则B一定是气体 D、B和C一定都是固体
7、将铁屑溶于过量盐酸后,加入KSCN溶液,再加入下列物质溶液,仍不出现红色的是
A、氯水 B、硝酸锌 C、过氧化氢 D、稀硫酸
6、在100mL等物质的量的HBr和H2SO3的溶液里通入0.01molCl2,有一半的Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的物质的量浓度等于
A、0.0075mol/L B、0.008mol/L C、0.075mol/L D、0.08mol/L
5、等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5 : 6,则甲、乙两烧杯中的反应情况可能分别是
A、甲、乙中都是铝过量 B、甲中铝过量、乙中碱过量
C、甲中酸过量,乙中铝过量 D、甲中酸过量,乙中碱过量
4、高温下硫酸亚铁发生如下反应:2FeSO4 Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是:
A、BaS B、BaSO3 C、BaSO4 D、BaSO3和 BaSO4
3、下列叙述正确的是
A、最外层电子数较少的金属一定比最外层电子数较多的金属还原性强
B、同一主族的元素从上到下,金属性呈现周期性变化
C、非金属元素的氢化物不一定只有一种
 D、具有相同电子层结构的aA2+与bB-中,a=b
D、具有相同电子层结构的aA2+与bB-中,a=b
2、氮化硅(Si3N4)是一种新型的耐高温耐磨材料,工业上有广泛用途。下列物质中能与氮化硅归纳为一类的是
A、氮化镁(Mg3N2) B、石英 C、四氟化硅 D、钨
1、以下说法正确的是
A、纳米材料是指一种称为“纳米”的新物质制成的材料
B、绿色食品是指不含任何化学物质的食品
C、四种分散系中的分散质微粒直径和纳米材料的粒子具有数量级的是乳浊液
D、光导纤维是以二氧化硅为主要原料制成的
21.某工厂处理含二氧化硫废气时采用“将二氧化硫转化为硫酸铵”的方法。该厂初步处理
后的废气中氧气的体积分数为10%,二氧化硫的体积分数为0.2%。使该废气在400℃时以5m3/h的速率通过催化剂层与速率为20L/h的氨气混合,再喷水使之发生反应,2NH3+H2SO4 (NH4)2SO4将得到的溶液在结晶装置中处理,可得到硫酸铵晶体。将气体都折合为标准状况下进行计算:
(NH4)2SO4将得到的溶液在结晶装置中处理,可得到硫酸铵晶体。将气体都折合为标准状况下进行计算:
(1)该工厂为什么将废气以5m3/h的速率与速率为20L/h的氨气混合为最佳配比(用计算说明 )?
(2)若该厂每天排放10000m3这种废气,按上述方法该厂每月(30天)计算可得到硫酸铵多少 吨?消耗氨气多少m3?
考查目的:本题是为保护环境处理废气中的SO2的方法之一,并且要从量的角度对处理过程中所涉及的反应物、生成物进行计算。培养学生的环保意识及分析处理实际问题的能力。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com