
题目列表(包括答案和解析)
6、下列钠元素的化合物,无天然存在的是:
①氧化物 ②氢氧化物 ③碳酸盐 ④硝酸盐 ⑤硫酸盐
A、①② B、除④外 C、除④⑤ D、不属于上述组合
5、下列各组比较不正确的是:
A、熔点: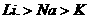 B、碱性:
B、碱性:
C、还原性: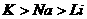 D、密度:
D、密度: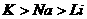
4、下列物质中能使品红试液褪色的是:①活性碳 ②过氧化钠 ③次氯酸钠 ④二氧化硫 ⑤干燥氯气 ⑥双氧水 ⑦臭氧
A、除①以外都可以 B、除⑤以外都可以 C、只有②③④⑥⑦可以 D、全部都可以
3、钠的下列用途与钠的化学性质无关的是:
A、制取过氧化钠 B、作原子反应堆的导热剂 C、冶炼金属钛 D、应用在电不源上
2、下列各组中的两物质作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是:
A、Na和O2 B、NaOH和CO2 C、Na2O2和CO2 D、NaCl和浓H2SO4
1、下列叙述不正确的是:
A、Na的化学性质很活泼,它在自然界中不能以游离态存在
B、Na2CO3比NaHCO3热稳定性强
C、Na2O与Na2O2都能与水反应产生,同时放出O2
D、等物质的量的Na2CO3和NaHCO3分别与足量的盐酸反应,Na2CO3放出的CO2比NaHCO3少
[答案: C、D ] [解析: ]
3、Na2CO3与NaHCO3比较:
|
名称 |
碳酸钠 |
碳酸氢钠 |
|
俗名 |
纯碱或苏打 |
小苏打 |
|
水溶性 |
易溶于水,溶液呈碱性 |
易溶于水(比碳酸钠溶解度小),溶液呈碱性 |
|
稳定性 |
稳定,但晶体碳酸钠易风化 |
受热易分解 |
|
与H+反应 |
CO32-+2H+=CO2↑+H2O |
HCO3-+H+=CO2↑+H2O |
|
与硫酸铝等盐反应 |
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ |
Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
|
相互转化 |
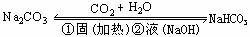 |
典型例题分析:
例1:将同样大小的金属钠,分别加入①MgCl2溶液 ②饱和NaCl溶液 ③NH4Cl溶液中,各发生什么现象?主要生成物是什么?
。
例2:可能由CO、CO2和O2组成的混合气体30mL,通过足量的Na2O2,经充分反应后,气体体积变为25mL,引燃剩余气体,恢复到原温度,测得体积变为20mL(气体体积为相同条件下测得)。求原混合气体中O2的体积是多小mL?
例3:将mmolNaHCO3和nmolNa2O2的固体混合物置于密闭容器中,加热到250℃时,使其充分反应。当n/m的比值在不同范围时,分析最后生成的气体和残余固体的可能组成是什么?
课堂练习:
2、Na2O与Na2O2的比较:
|
氧化物 |
Na2O |
Na2O2 |
|
电子式 |
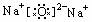 |
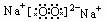 |
|
属类 |
可溶性碱性氧化物 |
非碱性性氧化物 |
|
生成条件 |
常温下缓慢氧化 |
燃烧或加热 |
1、单质钠的化学性质:
钠原子最外层只有一个电子,在反应中极易失去这个电子,所以单质钠具有强还原性,可与非金属单质(如:O2、X2、S等)反应,也可与水、酸、盐溶液和熔融的盐等到反应。在复习这些反应时应注意发下几点:
(1)不同条件下钠与氧气(或空气)反应的现象、反应物的用量、产物的结构和稳定性不同;
(2)钠与水反应的现象的原因解释;
(3)钠与水、酸、盐溶液的反应,实质上是钠原子与水或酸电离出的H+的反应,所以H+浓度不同,反应剧烈程度不同;
(4)金属活动顺序表吵氢后面的金属阳离子的氧化性虽然强于H+,但其反应速率远小于钠原子与H+的反应速率,故金属钠投入盐溶液中首先是与水的反应;然后再分析NaOH是否与盐发生复分解反应。如果是铝盐溶液,还要考虑钠和铝盐的量的问题,因过量的NaOH能溶解Al(OH)3;
(5)工业上利用钠作还原剂把钛、锆、铌、钽等金属从它们的熔炉融卤化物中还原出来,不能有水的参与;如: 。
。
27、为测定一种复合氧化物样品中的磁性粉末材料的组成,称取12.52克样品,将其全部溶于过量稀硝酸后,配成100毫升溶液。取其一半,加入过量K2SO4溶液,生成白色沉淀,经过滤、洗涤、烘干后得4.66克固体。在余下的50毫升溶液中加入少许KSCN溶液,显红色;如果加入过量NaOH溶液,则生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20克固体。(1)计算磁性粉末材料中氧元素的质量百分含量。(2)确定该材料的化学式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com